en
names in breadcrumbs


Plasmopara viticola, és l'agent causant del míldiu de la vinya. És un oomicet heterotàl·lic que sobreviu en forma d'oòspores en les fulles caigudes a terra i en el sòl. A la primavera, les oòspores germinen i produeixen macrosporangis, els quals sota condicions humides alliberen zoòspores. La pluja esquitxa les zoòspores a la part superior de la vinya, on neden i infecten els estomes. Després de 7-10 dies apareixen lesions a les fulles. Amb una meteorologia favorable, les lesions esporulen i es presenten noves infeccions secundàries.[5]
Plasmopara viticola,es considera el patogen més important i devastador de la vinya a Europa i Amèrica del Nord. Aquest fong va ser primer observat als Estats Units cap a 1834 i poc després va ser introduït a Europa, començant per França on segns els anys fa perdre el 50%, o més, de la producció de vi.[6][7]
Els símptomes del míldiu de la vinya inclouen la necrosi de la tija i dels brots, decoloració incloent taques marrons (lesions) i puntes de color verd groguenc a les fulles. Els grans de raïm poden mostrar esporangis o micelis que apareixen com una capa de blanca a grisa en les fulles.
Aquest míldiu requereix condicions òptimes per a la seva reproducció i infecció. Cal un ambient calent i humit que no és el que predomina en un clima mediterrani, excepte en les tempestes d'estiu.[8]
Delta-viniferin és una fitoalexina que es produeix en el raïm a continuació d'una infecció fúngica en la vinya per P. viticola.[9]
Plasmopara viticola, és l'agent causant del míldiu de la vinya. És un oomicet heterotàl·lic que sobreviu en forma d'oòspores en les fulles caigudes a terra i en el sòl. A la primavera, les oòspores germinen i produeixen macrosporangis, els quals sota condicions humides alliberen zoòspores. La pluja esquitxa les zoòspores a la part superior de la vinya, on neden i infecten els estomes. Després de 7-10 dies apareixen lesions a les fulles. Amb una meteorologia favorable, les lesions esporulen i es presenten noves infeccions secundàries.
Der Falsche Mehltau der Weinrebe ist eine Pflanzenkrankheit bei Weinreben. Erreger ist der Eipilz Plasmopara viticola. Im Weinbau hat er eine besondere wirtschaftliche Bedeutung, da er erhebliche Schäden verursachen kann. Das Pathogen kommt ursprünglich auf wildwachsenden nordamerikanischen Rebarten vor und wurde im Jahr 1878 nach Europa eingeschleppt – vermutlich mit Rebmaterial, das für die Verwendung als Unterlage zur Bekämpfung der Reblaus eingeführt wurde. Die umgangssprachliche Bezeichnung Peronospora leitet sich aus dem Gattungsnamen und der ursprünglichen Benennung Peronospora viticola ab. P. viticola kann sich ausschließlich von lebendem pflanzlichen Gewebe der Rebe (wirtsspezifisch) ernähren und darauf fortpflanzen (obligat biotrophe Lebensweise).
Ein Blattbefall lässt sich zunächst durch Aufhellungen an der Blattoberseite erkennen, die als „Ölflecken“ bezeichnet werden. In feuchten Nächten kommt es zur Ausbildung von Sporangienträgern, die aus den Spaltöffnungen (Stomata) austreten, wodurch die Blattunterseite wie mit Mehl bestäubt erscheint. Im späteren Verlauf nekrotisieren die Befallsstellen, wodurch die Photosyntheseleistung und damit auch die Zuckereinlagerung in die Beeren deutlich reduziert wird. Durch den Befall eines Gescheins vor oder während der Blüte oder an den jungen grünen Beeren entsteht das Symptom der „Lederbeerigkeit“. Dabei trocknet die Beere aus und die Beerenhaut wird lederartig zäh. Ein solcher Befall kann zu vollständigen Ernteausfällen führen.
P. viticola überwintert im Falllaub am Boden in Form von geschlechtlich gebildeten Oosporen. Diese keimen im Frühjahr bei Temperaturen ab 11 °C aus und bilden Primärsporangien, die bei Wasserkontakt eine große Anzahl begeißelter Zoosporen entlassen. Durch aufspritzende Regentropfen gelangen diese auf die Blattunterseite und schwimmen aktiv durch den Wasserfilm zu den Spaltöffnungen (Stomata). Nach dem Anheften bildet das Pathogen eine Infektionhyphe aus, mit dem es in das Aerenchym (Atemgewebe) des Blatts eindringt. Bei Kontakt mit einer Zellwand bildet die Infektionshyphe ein Appressorium aus, um die Zellwand zu durchdringen und im engen Kontakt mit der Pflanzenzelle ein Haustorium zur Nährstoffaufnahme auszubilden. Anschließend erfolgt die weitere intrazelluläre Ausbreitung mit der Bildung weiterer Haustorien innerhalb eines Interkostalfeldes.
In einem asexuellen Lebenszyklus erfolgt eine epidemische Ausbreitung über die weitere Vegetationsperiode. Dabei kommt es zur Ausbildung von bäumchenartigen Strukturen, den Sporangienträgern, an deren Astenden sich asexuelle Sporangien abschnüren. Diese gelangen durch Wind und Regen auf neue Reben, um bei Wasserkontakt ebenfalls begeißelte Zoosporen freizugeben und neue Infektionen auszulösen.
Kommt es im Pflanzengewebe zum Kontakt zwischen gegengeschlechtlichen (heterothallischen) Hyphen, findet insbesondere im Herbst eine sexuelle Vermehrung statt, aus der die winterharten Oosporen für die Neuinfektion im nächsten Jahr entstehen.
Der französische Botaniker Pierre-Marie Alexis Millardet entdeckte 1882 zufällig die Wirksamkeit von Kupfer gegen den Falschen Mehltau und entwickelte mit der Bordeauxbrühe das erste erfolgreiche Fungizid. Auch heute noch werden kupferhaltige Zubereitungen im Weinbau eingesetzt und sind im ökologischen Weinbau das zugelassene und effizient gegen P. viticola wirkende Pflanzenschutzmittel. Ansonsten stehen dem Weinbau inzwischen weitere wirksame Fungizide aus verschiedenen Stoffklassen zur Verfügung, die jedoch fast ausschließlich protektiv (vorbeugend) wirksam sind und deshalb vor einer Infektion ausgebracht werden müssen. Dies resultiert in einem hohen Pflanzenschutzaufwand für den Winzer. Prognosemodelle, wie beispielsweise VITIMETEO, sollen die Winzer bei der Wahl der richtigen Spritzzeitpunkte unterstützen.
Eine weitere Möglichkeit, den Fungizidaufwand zu reduzieren, ist der Anbau pilzwiderstandsfähiger Rebsorten. Inzwischen stehen Rebsorten mit Mehltauresistenzen und sehr guten Qualitätseigenschaften zur Verfügung. Die in Deutschland bislang erfolgreichste pilzwiderstandsfähige Rebsorte ist Regent.
Zur Unterstützung der Wirksamkeit der Kupferanwendungen können Kaliumphosphonate eingesetzt werden. Die Chemikalie wurde als Pflanzenstärkungsmittel 2013 für den ökologischen Weinbau zugelassen. Mittlerweile stuft die deutsche Pflanzenschutzverordnung das Mittel jedoch als Pflanzenschutzmittel ein und es kann im ökologischen Weinbau nicht mehr eingesetzt werden.[1][2]
Der Falsche Mehltau der Weinrebe ist eine Pflanzenkrankheit bei Weinreben. Erreger ist der Eipilz Plasmopara viticola. Im Weinbau hat er eine besondere wirtschaftliche Bedeutung, da er erhebliche Schäden verursachen kann. Das Pathogen kommt ursprünglich auf wildwachsenden nordamerikanischen Rebarten vor und wurde im Jahr 1878 nach Europa eingeschleppt – vermutlich mit Rebmaterial, das für die Verwendung als Unterlage zur Bekämpfung der Reblaus eingeführt wurde. Die umgangssprachliche Bezeichnung Peronospora leitet sich aus dem Gattungsnamen und der ursprünglichen Benennung Peronospora viticola ab. P. viticola kann sich ausschließlich von lebendem pflanzlichen Gewebe der Rebe (wirtsspezifisch) ernähren und darauf fortpflanzen (obligat biotrophe Lebensweise).
Li mildiou del vegne, c' est on mildiou k' acsût les vegnes.
Il a stî responsåve — avou des ôtes sacwès —, å cminçmint do 20inme sieke, del rwene des vignrons totavå l' Urope, aprume e l' France.
No d' l' indje e sincieus latén : Plasmopara viticola
On stritche do soûfate di keuve (CuSO4, «boleye di Bordo») dispu l' 19inme sieke, aprume po-z espaitchî l' rascråwe cwand il a fwait crou ou brouhiner.
Cwand l' vegne est ddja bén atakêye, on sieve asteure pus voltî des towe-tchampion come li ciproconazole.
Li mildiou del vegne, c' est on mildiou k' acsût les vegnes.
Il a stî responsåve — avou des ôtes sacwès —, å cminçmint do 20inme sieke, del rwene des vignrons totavå l' Urope, aprume e l' France.
No d' l' indje e sincieus latén : Plasmopara viticola
Peronospora je bolest vinove loze koju uzrokuje gljiva latinskog naziva Plasmopora viticola. Bolest je prenesena iz Sjeverne Amerike krajem 19. vijeka i to podlogama koje su se koristile za razmnožavanje evropske vrste loze (Vitis vinifera).
Peronospora je endoparazit tj. njeno vegetativno tijelo (hife odnosno micelij) nalaze se u unutrašnjosti lista, bobe i izdanka. To jedna od najopasnijih bolesti vinove loze. Evropska loza (Vitis vinifera), odnosno plemenita loza, neće donijeti urod ako nije zaštićena od peronospore.
Peronospora je bolest vinove loze koju uzrokuje gljiva latinskog naziva Plasmopora viticola. Bolest je prenesena iz Sjeverne Amerike krajem 19. vijeka i to podlogama koje su se koristile za razmnožavanje evropske vrste loze (Vitis vinifera).
Peronospora je endoparazit tj. njeno vegetativno tijelo (hife odnosno micelij) nalaze se u unutrašnjosti lista, bobe i izdanka. To jedna od najopasnijih bolesti vinove loze. Evropska loza (Vitis vinifera), odnosno plemenita loza, neće donijeti urod ako nije zaštićena od peronospore.
Plasmopara viticola es un pseudomycota de la familha de las Peronosporaceae de la classa dels Oomycetas. Existís jos la forma d'espòras liuras o de micèli podent créisser pas que dedins lo teissuis de la vinha que parasita. Es l'agent patogèn del mildió de la vinha. Apareguèt en França en 1878, importat del continent american.
Etimologia: lo tèrme Plasmopara se decompausa[1] en plasmo- (representant plasmode « estructura de mai d'un nuclèus », del latin plasma- « forma, figura » + sufixe -ode « semblable ») e -para forma femenina en latin scientific de -pare. Lo tèrme viticola empruntat al latin viticola « vinharon ».
Abans 1845, las vinhas europèas (Vitis vinifera) coneissavan ni oïdium, ni filloxèra e tampauc lo mildió. En unas decennias pasmens, aquela malautiás vengudas d'America del Nòrd destruson lo vinhal europèu: l'oïdium arribèt en 1845, le filloxèra en 1861-1863 e lo mildió de la vinha seguèt en 1878[2]. Jules Émile Planchon foguèt lo primièr qu'o detectèt en Occitània e tanben se trapèt dins la region de Lion, en Itàlia e en Soïssa.
L'agent del mildió de la vinha aviá estat descriu jol nom de Botrytis viticola per Berkeley e Curtis en 1848. Mas la resolucion del biais d'accion d'aquel patogèn o realizèt un microbiologista Alemand, Anton de Bary en 1863. Aquel grand davancièr de l'estudi dels mycotas aviá entre autre descobèrt lo cicle de desvelopament sexual de l'oomycèta Phytophyhora infestans provocant le mildió de la trufa. De Bary descriguèt tanben los cicles sexual e asexual del mildió de la vinha[3] e plaça lo patogèn responsable jol genre Peronospora o amb le nom d'espècia Peronospora viticola (De Bary 1863).
Vint e cinc ans mai tard, Berlese e De Toni (1888) tornèron plaçar l'agent del mildió de la vinha dins lo genre Plasmopara. Aquel darrièr produit dels sporocystas (o esporangs) ont las zoospòras diploïdas son produchas, alara que los Peronospora germenan per de tubes de germinacion.
Fin finala, lo darrièr grand remanejament ven dels estudis de filogenetica[4] qu'an sortit los oomycètas del regne dels Fungi pels plaçar dins los Bikonta, division dels Estramenopilas (o eterocontas).
Plasmopara viticola es un endoparasita obligatòri que se desvolopa pas que dins los teissuts verds de la vinha e subretot dins lo parenquima de las fuèlhas[5]. Viu als depens dels teissuts que parasita e qu'acaba per los destruire. Sèm pas encara capable de lo cultivar dins un mitan sintetic[6]. Pendent son cicle de desvelopament, Plasmopara viticola demora subretot jos la forma diploïd. S'es plan capable de fecondacion crosada entre filaments micelians de tipe genetic diferents[7], las gametas (aploïdas) demoran totjorn a l'interior de las formacions micelianas, nomenadas gametocistas.
P. viticola se caracteriza tanben pel fach que los filaments de son micèli an pas de parets, qu'es pas que cellulosica (a la diferéncia dels Eumicètas que contienon de quitina) e que las zoospòras son biflagelladas. Lo passatge per l'estat filamentós de son micèli e son eterotrofia l'apròchan d'unes mycotas vertadièras (Eumycètas) mas es lol resultat d'une convergéncia evolutiva. Sa classificacion filogenetica lo plaça dins los Oomycèta, mai pròche de las algas brunas e de las diatomèas que de las « mycotas vertadièras » Eumycètas[4].
P. viticola es una espècia endemica sus las espècias fèras de Vitis d'America del Nòrd[3]. Tanben la diferentas espècias nordamericanas venguèron mai o mens resistantas: Vitis rupestris es mejanament resistanta e Vitis rotundifolia (o muscadina) es resistanta[8]. Al contrari, la vinha europèa (Vitis vinifera cultivada) que longtemps evoluèt fòra de tot contacte amb aquel patogèn, es fòrça sensible.
Lo pseudomycota P. viticola se manifesta jos tres formas diferentas pendent son cicle de desvelopament. Passa pels estadis oospòras, zoospòras e micèli e lors fructificacions respectivas (o esporocistas). Las espòras possedisson la lor sèrva energetica intèrna. L'oospòra es un uòu, obtengut per crosament "sexuat" entre dos talles (crosament eterotallic). La zoospòra es una espòra dotada de dos flagèls li servisson per se mòure dins lo prim film d'aiga a la superfícia dels teissuts vegetals. Los dos tipes d'espòras posan dons la lor sèrva energetica per créisser o se desplaçar. Al contrari, lo micèli se desvolopa obligatoriament a l'interior dels teissuis de la vinha. Se noirís pas qu'al depens de las cellulas vegetalas de la vinha amb per consequéncia de damatges istologics podent provocar possiblament de pèrdas de culhidas importantas.
Lo developament de Plasmopara viticola se fa seguent dos cicles imbricats[3]:
Dins una seccion endejós, cada estapa d'ambedos cicles de reproduccion son detalhats.
Las oospòras son d'uòus formadas al dedins dels teissuts de la vinha pendent la davalada. Après la casuda de las fuèlhas, subrevivon dins la jaç del sol.
A la prima, quand la temperatura passa 12 °C, las oospòras germinan e fan naisser a fòrça zoospòras. Amb las pluèjas de la prima, las zoospòras son projectadas pels regiscles d'aiga suls organs aerians de la vinha mai pròches del sol[6]. Las zoospòras migran alara cap als estomats, perdon lors flagèls e donan un promicèli que penètra lo limbe. Aquel produsís fòrça ifas micelians que s'infiltran entre las cellulas, envasissent completament une zona de teissuts e provòcan una lesion locala.
Sus las fuèlhas, apareisson doas formas de lesions: a) de tascas mai o mens circulàrias, translucidas fins a oliosas, nomenadas « tascas d'òli » que pro rapidament venon jaune puèi se necrosan. Mejans la fuèlha, un fulham blanquinós se realiza rapidament. Correspond a las fructificacions (o esporocistofòras) dona a l'exterior pel micèli infectant. Fòrça zoospòras son liberadas e van espandirl'infeccion b) de tascas d'espandiment limitadas, de forma poligonala car limitadas per las nervuraduras, mai o mens cloroticas a necroticas[6]. Apareisson subretot a la davalada sus las fuèlhas vielhas.
Suls rams joves, apareisson de lesions superficialas longitudinalas, de color bruna, podent provocar una desformacion de la tija. De fructificacions de P. viticola pòdon tanben sortir del ram.
Las inflorescéncias e los rasims son tanben sensibles al mildió. D'esporocistofòras pòdon tanben s'i desvelopar. Los rasims tocats mai tardierament presentan de tascas brunas fins negrencas, deprimits non fructifèrs.
Atal a la prima, una oospòra de l'an passat, germina e dona de fòrça zoospòras que van contaminar los teissuts de la vinha. Pendent aquela infeccion primària, lo micèli dens que se desvolopa dedins los teissuts, produsís de suçadors (o hausterium) que voidan las cellulas de l'òste de lors nutriments e de lor aida. Lo mildió se desvelopa totjorn dempuèi aqueles fogals primaris d'infeccion. Aqueles fogals primaris apareisson gaireben totjorn als meteis luòcs dins un vinhal e an un espandiment limitat[9].
D'aquelas lesions naisson de fructificacions exterioras, nomenada d'esporocistofòras (o esporangiofòras, apareisson jos forma de feutratge blanc) que quand madur, libèran fòrça zoospòras. Aquelas pels meteis procediment de dispersion-penetracion envasissent de las zonas sanitosas dels teissuts e realizan d'infeccions secondàrias.
La temperatura e l'umiditat tòcan lo desvelopament de P. viticola. Dempuèi de temps, los viticultors observèron que se desvolopava pendent los periòds pluvencs e las temperaturas doças.
Mai precisament, lo cicle de desvelopament de P. viticola. Se descompausa en: i) una reproduccion sexuada[10] (per crosament eterotallic), a la davalada al moment de la senescéncia de las fuèlhas e destinada a contunhae l'espècia pendent la sason freda fins al retorn de la vegetacion de la vinha ii) una reproduccion asexuada (o clonala) pendent la sason vegetativa, destinada a espandir rapidament l'epidemia.
Los cicles de reproduccion de Plasmopara viticola 1. Maturatcion de las oospòras: las oospòras son d'uòus diploïdes formats a davalada dins los teissuts mildiozats que van se manténer subretot a l'interior de las fuèlhas mòrtas e tanben sul sol, pendent tot l'ivèrn. Sul sol, la sèrva d'oospòras pòt variar de 100 a 30 000 espòras per mètre carrat[11].Envelopadas dins una dobla paret solida[12], las oospòras son las solas estructuras de P. viticola capablas de subreviure a de condicions ivernalas dificilas veire extrèmas, car pòdon suportar de temperaturas de - 20 °C. Las oospòras començan a èsser maduras en novembre e lo fred perlongarà lor aptitud a germinar pendaet de meses.
Lo taus de germinacion de las oospòras cammbian amb lo temps e a partir de març, s'obsèrva un efièt positiu de la pluèja sul taus de germinacion[13]. Las oospòras gardan quitament lor aptitud de germinar mai d'un ans[14].
Germinacion de l'oospòra
3. Liberacion e espandiment de las zoospòras: los nuclèus se multiplican per division mitotica, tan plan que cada esporocista pòt liberar de 60 àa 200 espòras mononucladas, nomenadas zoospòras. Los regiscles de pluèja e de tèrra a l'escasença de las fòrtas precipitacions espandisson los esporocistas e las zoospòras suls teissits de la vinha.Los zoospòras se desplaçan mercé a lors dos flagèls dins lo prim film d'aiga a la fàcia inferiora de las fuèlhas e los rasims, per trobar un estomat ont penetrar. Las zoospòras pausadas a la superfícia que lèu seca , subrevivon pas. Al contrari de las oospòras, lor durada de vida es fòrça corta.

Liberacion de las zoospòras per un esporocista
4. Germinacion de la zoospòra: quatre a cinq zoospòras s’aglomèran a l'entorn d'un estomat obèrt e perdon lors flagèls. Realizan un tube germinatiu (o sifon infestant o promicèli) que penètra lo limbe de la fuèlha e mena a la formacion d'una vesicula sosestomatica dins lo clòt sosestomatic[5].5. Infeccion primari: lo citoplasme de las zoospòras es transmes a aquela vesicula que rapidament dona un haustorium (suçador) primari cap a una cellula òsta. Aquel inocul primari (o infeccion primària) marca lo començament del cicle agamic. Los primièrs symptòmas se manifestan una desena de jorns après[6], es lo periòde d'incubacion. Un micèli se desvolopa dins los espacis intercellularis e s'alimenta per de suçadors (haustoria) que penetran las cellulas del penquima e de l'epidèrme. Rapidament, aqueles haustoria secondaris penetran la paret de las cellulas vegetalas per pompar l'aiga e lo nutriments que contienon. Los teissuts lacunoses son rapidament colonizats. Un còs sosestomatal se desvolopa e despega lo teissut epidermic del tissut parenquimatós, çò que dona lo simptòma de la « tasca d'òli », una tasca translucida apareisson 4 a 5 jorns après lo començament l'infeccion. Lo jauniment de la fuèlha a causa de la pèrda de pigment clorofillian (del parenquima palissadic) pòt aparéisser dempuèi lo ochen jorn après lo començament de l'infeccon. En mai las infeccions primàrias de començament d’epidemie, Gobbin et al[15] mostrèton que las infeccions primàrias se perlongariá tot lo long de l’epidemia, quin que siá lo moment entre mai e agost.

4. Germinacion de la zoospòra. La nada de la zoospòra fins a l'estomat, la germinacion e la penetracion[3] se fa en 3 oras a 20 °C
5. Infeccion primària: desvelopament del micèli
A aquela estapa, doas vias de reproduccion comançan alara:
6a.2. Germinacion dels esporocistas: après division mitotica dels nuclèus, los esporocistas libèran 3 a 8 zoospòras dins l'aiga liura, 5 a 10 jorns mai tard. Las condicions requeridas son una temperatura t> 13 °C (e temperature optimala de 19 °C) e una umiditat de 98 %.
6a.3. Lo cicle de reproduccion asexuada es tancant per un espandiment e una germinacion dels zoospòras dins un estomata (estape 4) e una infeccion (estapa 5) qu'aquel còp se dich « segondària ».
L'esporulacion marca lo començament d'un cicle secondari: los zoospòras son espandits per aura per aténher e contaminar de fuèlhas novèlas.

Esporulacion: sortida d'esporocistofòrs portant d'esporocistas que libèran de zoospòras. L'esporulacion se fa en 7 oras, a l'escur (es inibada per la lutz[3]). Los zoospòras s'espandisson e provòcan una infeccion secondària
Las òbras de Gobbin et als[15] (2008) mostrèton que las contaminacions secondàrias per aque cicle asexuat son mens importantas que ce que se pensava.
6b. Reproduccion sexuada: 6b.1. Meïòsi: pendent la davalada, al moment de la senescéncia de las fuèlhas, los filaments del micèli de P. viticola forman d'organs sexuats (o gametocistas) que la totalitat de lor contengut evolua en gamètas per meïòsi. Lo gametocista mascle[N 2] (o espermatocista ou anteridia) contien las gamètas masclas que sont de fach redusits a un nuclèu aploïde e lo gametocista feme (o oogòn) conten d'oosfèras amb un nuclèu feme aploïde e de sèrvas. Dos gametocistas venent de micèli geneticament diferents s'acòlan alara l'un a l'autre (crosament eterotallic, Wong et al.[7]).6b.2 De tubes copulators parton dels espermatocistas e penetran l'oogòn per permetre als nuclèus mascle d'anar fecondar los gamètas femes. I a pas de gamètas liberats a l'exterior que las fecondacions se produson dins l'oogòn.
6b.3 Formacion de las oospòras: la fecondacion se fa a l'interior de l'oogòn. Aquela produch un zygota o oospòra.
6b.4 Liberacion de las oospòras. Aquela estapa tanca lo cicle sexual per un retorn a l'estapa 1. Quitament jos las condicions de temperatura e d'umiditat optimalas, las oospòras germinan pas abans genièr-febrièr. Lo cicle de la reproduccion sexuada se fa sus una an alara qu'aquel de la reproduccion asexuada se fa en un temps fòrça mai cort pendent la sason vegetativa.
Aquel biais de reproduccion nomenat oogamia sifonogama es caracteristic dels Oomycètas.

La luta contra lo mildió s'organiza subretot amb de mesuras preventivas. Car s'es possible d'arrestar una ataca, los damatges un còp causats sus las inflorescéncias e rasims, son par contre irremediables.
De precaucions son indispensablas per evitar l'installacion de fogals primaris podent venir d'oospòras avent passats l'ivèrna l nivèl del sol e qu'aprèe germinacion dona de zoospòras contaminantas[9]:
La pulverizacion de fongicids antimildió se fa d'en primièr de biais preventiu suls organs sans per evitar lor infeccion. Per decidir del moment que cal e evitar de tractaments inutils, lo viticultor pòt s'ajudar de sistèmas d'ajuda a la decision o se far conselhar près dels tenicians. Empiricament, se sap que lo risc d'una germinacion precòça de las oospòras correspond a un periòde davalada-ivèrn-prima doç e pluvenx. Una autre règla empirica[16] dichas dels "3-10" indica qu'una infeccion primària es importanta se 1) la temperatura passa los 10 °C 2) los joves rebrots fan mai de 10 cm de long e 3) casèt al mens 10 mm de pluèja en 24-48 oras.
Pendent lo periòde de creissença de la vinha, cal enseguida realizar de pulverizacions regulara de fongicids segon la velocitat de creissença de la vegetacion, de la frequéncia de las pluèjas, de la temperatura e de la pression parasitària[11]. Dempuèi un vetenat d'ans, fòrça modèls d'ajuda a la decision son prepausat. Lo modèl de Caffi et al[16] (2009) es un modèl sistemic qu'intègra l'influéncia de la pluviometria, de l'umiditat relativa, de la temperatura sus la maduracion d'un cohòrt d'uòus d'ivèrn, lor germinacion, lor produccion d'esporocistas, e la liberacion e l'espandiment de las zoospòras. Lo modèl "Potentiel Systèmes" calcula, en foncion de las donadas meteorologicas presas sus diferents sectors del vinhal, de variablas representant subretot la maduretat dels uòus d'ivèrn, la pression realizada per diversas malautiás e las datas de contaminacion.
Lo tractament fongicid tradicional realizat dempuèi la fin del sègle XIX èra la borida bordalesa. Foguèt lo sol produch utilizat fins a la mitat del sègle XX mas foguèt remplaçat rapidament remplançat pels fongicids de sintèsi. Ara, una pletòra de fongicids antimildió son prepausat. Se los pòt classificar en tres grandas classas: los produchs de contactes, los produchs penetrants e los sistemics.
Plasmopara viticola es un pseudomycota de la familha de las Peronosporaceae de la classa dels Oomycetas. Existís jos la forma d'espòras liuras o de micèli podent créisser pas que dedins lo teissuis de la vinha que parasita. Es l'agent patogèn del mildió de la vinha. Apareguèt en França en 1878, importat del continent american.
Plasmopara viticola, the causal agent of grapevine downy mildew, is a heterothallic oomycete that overwinters as oospores in leaf litter and soil. In the spring, oospores germinate to produce macrosporangia, which under wet condition release zoospores. Zoospores are splashed by rain into the canopy, where they swim to and infect through stomata. After 7–10 days, yellow lesions appear on foliage. During favorable weather the lesions sporulate and new secondary infections occur.[5]
Plasmopara viticola, also known as grape downy mildew, is considered to be the most devastating disease of grapevines in climates with relatively warm and humid summers. It was first observed in 1834 by Schweinitz on Vitis aestivalis in the southeastern United States.[6] Shortly after this first observation, the pathogen was introduced to European countries where it played a devastating role in the yield and production of their grapes, and consequently their wine. France was among the first of the European countries to gain experience in dealing with the pathogen. Within just a few years of the pathogen's introduction the French attempted to graft American root stock to their own vines in order to produce a more resistant strain of grape. Depending on the year, production of grapes in France has been estimated to have been reduced by as much as 50%.[1] Because of numbers and results like these, downy mildew has been considered the most devastating disease of a filamentous pathogen to affect European vineyards.[3][2][7] When comparing three grape producers in Europe, including some fields that were treated with fungicides or other management strategies, the economic losses ranged from ~2000 euros per hectare to ~4250 euros per hectare.
Symptoms cover a fairly large range depending mostly on the host. Common symptoms include necrosis of the stem or shoot, discoloration including brown spotting (lesions) and yellowish-green tips of the leaves. Grapes may exhibit sporangia and sporangiophores, appearing as white to gray coat on the outer surface.
Downy mildew has a specific set of environmental conditions to reproduce and infect. A warm, moist, and humid environment is required. Studies in Sicily have shown optimum time for oospore germination is between the end of February and the middle of March.[4] With this understanding, if fungicides are used just before optimum conditions occur, they have proven to be an effective control method of the pathogen. Other control methods include proper watering, and a good location where the plant can receive continual sunlight.
Oospores, the sexual structures of Plasmopara viticola, are produced in late summer. The pathogen can survive winter as oospores in host tissue like dead leaves on the vineyard floor. There they can survive up to 3–5 years, possibly up to 10 years.[8] Oospores may also be released from decaying plant material on soil surfaces.
The "rule of thumb", 10:10:24, refers to the required environmental condition for primary infection. At least 10mm rainfall (or irrigation) is needed while the temperature should be 10 °C or more over 24 hours.[8] Under favorable conditions, oospores would germinate.
In spring the oospores would produce sporangia, which then produce zoospores, the swimming spores. Zoospores and sporangia can be dispersed by rain and wind to some lower tissue of the grapevines.
Sporangia can decline in viability over time. After 10 days in a 15°C humid chamber sporangia will die. Sporangia that are exposed to direct light for over 15 minutes will not survive.[9] [10]
Once the zoospores are produced and land on the host plant tissue, the primary infection would occur. Primary infection is from soil to vine. Zoospores encyst and then germinate. The germ tubes would be formed and then invade into the plant tissue via stomates.[11] After infection, there would be oil spots on the leaf surface.
Active oil spots are necessary for secondary infection and sporangia are responsible for this process. Secondary infection is from leaf to leaf, shoot, inflorescence, berries, and stalk.[8] The sporangia, seen as the white fungal-like organism on the downside of the leaves, are produced after a warm and high humid night.[11] The sporangia can then be dispersed by wind or rain to occur secondary infections. Sporangia is the asexual reproduction structure, which then produce sporangiophores.[8] The secondary infection is repeatable as long as under suitable conditions.[5]
The hosts of Plasmopara viticola includes the species Vitis vinifera and all cultivars within the species. It also can affect any interspecific hybrids within the Vitis genus. There is also some susceptibility in the Vitis labrusca species, ranging from highly susceptible to resistant. The European cultivar is most susceptible to the pathogen, as it lacks evolutionary resistance that the American varieties have, because the pathogen originated in the Americas and was later transmitted into Europe.[12] North American species are also susceptible but varies from high susceptibility to resistance. In the regions with high annual rainfall, the grapevines may suffer more from this disease.[5]
The first symptom of downy mildew of grapes usually can be seen on leaves after 5 to 7 days of primary infection. Early in the season (spring), Yellow circular spots with oily appearances is going to present on foliage along with the veinlets. Note that, in some red grape varieties, the spots may in red color. The young oil-spots are surrounded by brown-yellow halos. As the oil-spots get mature, the halo would fade. As the oil spots age and develop, infected tissue would become necrotic and nonreproductive, due to cell death.[5] If under appropriate weather conditions, a larger number of oil-spots can develop, expand, and cover most of the leaf surfaces.
After a warmer and humid night, a white downy fungal growth (sporangia) would be abundant on the downsides of the leaves and other infected plant areas. The severely infected portion could die. Severely infected leaves may drop from the plant.[11]
The pathogen may also attack the old leaves in late summer.[11] The infected old leaves may present a mosaic pattern with yellow to red-brown spots on the upside of the leaves' surface.
The shoots of the plant can also be infected and shown as the same oily patches. After a warm humid night, these oily patches may also sporulate and be covered with white fungal growth.[8] The shoots are may also be distorted or curled after infection.
The grape fruits may also have the symptoms in the later season. The infected berries would turn brown, wither, and then die finally. The infected green fruit may turn light brown and purple. White fungal growth(sporulation) can abundant on the grapes during humid weather. Infected grapes are easy to detach from the pedicles.[11] However, the fruits become resistant to infection around 2–3 week after blooming, excluding the rachis. The rachis becomes resistant only around 2 months after blooming.
If the young bunch stalk is infected, oily brown sites can be seen. The infected inflorescence or bunches would wither rapidly. Infected inflorescence would eventually turn to brown, which means the death of the bunches.[8]
The disease development of grape downy mildew is known to be heavily reliant on the efficiency of the asexual propagation cycles. Kiefer et al. (2002) demonstrated that the early development of Plasmopara viticola is regulated specifically and coordinately by unknown factors originating from the host grapevine plant Vitis vinifera.[13] The host factors influence the pathogen development in three ways: (i) accelerating the release of zoospores from mature sporangia, (ii) coordinating the morphogenesis of the germ tube through the reorientation of the polarity of the zoospores during the attachment to the host cell, and (iii) targeting the zoospores to the stomata by active chemotaxis from the open substomatal cavity.[13] The expression of pathogenesis-related (PR) genes by the host plant V.vinifera during the infection of P.viticola has been investigated over the years. The expressions of PR-2, PR-3 and PR-4 genes are induced in the grapevine host during pathogen infection, which encode for cell wall-degrading enzymes B-1,3-glucanase (PR-2) and chitinases (PR-3 and PR-4).[14] It was previously understood that oomycetes differ from true fungi by the presence of cellulose in the oomycetes' cell walls as opposed to chitin in true fungi. However, it was found that chitin synthesis is regulated during in planta growth and asexual propagation of P.viticola and this is further demonstrated by the presence of chitin on the cell walls of the hyphae, sporangiophores and sporangia of the grape downy mildew pathogen.[15] Hence, both the cell wall-degrading enzymes are synthesized by the host grapevine plant specifically to target and degrade the cell walls of the oomycete pathogen.[14] In addition, the upregulation of the PR-9 gene that encodes for peroxidase, which is a reactive oxygen species is associated with the systemic acquired defense of the grapevine host.[14] The roles of other constitutively expressed PR genes during P.viticola infection such as PR-5, PR-1 and PR-10 genes remain ambiguous. PR-5 is involved in the synthesis of thaumatin-like proteins and osmotins, which are believed to inhibit the spore germination and germ tube growth of Plasmopara viticola by creating transmembrane pores.[14]
The history of downy mildew control began with an accidental discovery in 1882.[16] In order to prevent passersby from eating from grapevines close to the road, Pierre-Marie-Alexis Millardet sprayed those vines with a mixture of copper sulfate and lime, which was both seeable and awful-tasting.[16] He then noticed that the treated grapevines did not show any symptoms of downy mildew, whereas the rest of the vineyard was infected by the disease.[16] After further studies, Millardet published the recommended treatment of the grapevines against the downy mildew in 1885 in which he proposed the use of 8:15:100 of copper sulfate: hydrated lime: water mixture in the treatment (later named as Bordeaux mixture after the Bordeaux region where Millardet conducted the research).[16] The treatment of Bordeaux mixture against the downy mildew was well-received globally due to its strong adhesion to the leaves, its long perseverance in the vineyard, and its color, which allows for observable distribution of the treatment.[16]
Copper-based control methods are still commonly used today. As science became more precise, the amounts of copper-sulfate used in solution were optimized for best control of the Higher concentrations of copper-sulfate (3–4%) are recommended for high risk conditions, while low concentrations (1–1.5%) are for low risk conditions. The risk of susceptibility for the plant is highly correlated with the season.[12] Most of the ineffectiveness in fungicide use is correlated with spraying at inappropriate times. It is necessary to spray right before budding in the spring. Furthermore, coating the entire leaf with a film of the fungicide is necessary for control; thinning the foliage makes achieving an entire coat possible.[12] However, overusing chemical controls with copper can create harmful non-target effects. Copper can negatively impact the biological diversity in the soil and groundwater. [17]
Unlike in Vitis vinifera, there is a wide range of susceptibility to downy mildew among Vitis interspecific hybrids. For example, among North American grapevine species, Vitis aestivalis and Vitis labrusca are moderately susceptible while Vitis cordifolia, Vitis rupestris and Vitis rotundifolia are relatively resistant.[6] Certain Vitis interspecific hybrid cultivars display organ-specific resistance. For example, leaves of Aurore and Delaware cultivars are moderate to highly susceptible, whereas their fruit are highly resistant to downy mildew.[6] Another example is the cultivar Chancellor in which the leaves exhibit moderate levels of resistance to downy mildew, while the clusters, tendrils and shoot tips are highly susceptible to the disease.[6] Several new European cultivars such as Regent have been developed from progeny of crosses between V. vinifera and resistant North American species in an effort to incorporate the most desirable qualities of both parental branches.
Note that, berries become resistant to infection after 2 to 3 weeks after bloom, other parts of the plants may remain susceptible 2 months after bloom.[18]
Reduce the risk of disease when establishing the vineyards. This practice includes choosing the location, drainage, soil, and irrigation system.[18]
Avoid the distribution of infected soil and plant tissue from equipment.[8] Carefully clean the equipment or change equipment after used in the infected areas. Also, carefully clean the boots or clothes after entering the infected areas.
Canopy management practices, such as low planting density, vine trimming, and hedging, and later shoot thinning, can improve the air movement and make the leaves drier.[8]
Investigating in wild grape varieties to increase the genetic resistance. Develop the breeding of disease-resistant cultivars.[19] Resistant cultivars can be useful and efficient to avoid infection.
Automatic weather stations can be established for monitoring and predicting weather events. Collecting data from temperature, rainfall, leaf wetness, and humidity.[8]
Pre-infection fungicides prevent the zoospores to enter the leaf stomates. Also, post-infection fungicides can be used as soon as possible after infection to kill the pathogen tissues inside the leaves.[8] Chemical pesticides are useful methods to control this pathogen and downy mildew.[19]
Biological agents, like Epicoccum nigrum link, can inhibit the spread of spores of Plasmopara viticola.[20] Microorganisms can be used to biocontrol plant disease. However, microbial control agents do not work well. [19] A recent study (2020) has shown that the bacteria Ochrobactrum sp. may be a promising future biological control. However, there are no reports of the grape industry that have used the bacteria Ochrobactrum sp. as a control of grape downy mildew.[21]
In 1848, Berkeley and Curtis made reference to a downy mildew on grapevines, and, in a footnote, named it Botryis viticola.[22] However, Botryis viticola was a nomen nudum.[23] It was later transferred to Peronospora and then to Plasmopara. In 1907, Wilson erected Rhysotheca with P. viticola as the type;[24] however, the name Rhysotheca viticola never caught on.[22] In 1946, a strain on Vitis amurensis was raised to the species level as P. amurensis. In 1955, Golovina named the varieties americana, aneurensis, and parthica. In 1951, Alice Săvulescu and Traian Săvulescu named the formae speciales viniferae-ampelopsidis, aestivalis-labruscae, and silvestris based on host and morphology.[25] Later authors synonymized all these names back into P. viticola.[22] A population level analysis of P. viticola from the United States of America revealed the presence of four lineages that correspond to the host that could be distinguished based on molecular phylogenetics, morphology, and cross-inoculation experiments: P. viticola f. sp. quinquefolia, P. viticola f. sp. vinifera, P. viticola f. sp. aestivalis, and P. viticola f. sp. riparia.[26] Further study recognized an additional lineage: P. viticola clade vulpina.[27] The lineage Plasmopara f. sp. quinquefolia has been named Plasmopara muralis.[27]
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) Plasmopara viticola, the causal agent of grapevine downy mildew, is a heterothallic oomycete that overwinters as oospores in leaf litter and soil. In the spring, oospores germinate to produce macrosporangia, which under wet condition release zoospores. Zoospores are splashed by rain into the canopy, where they swim to and infect through stomata. After 7–10 days, yellow lesions appear on foliage. During favorable weather the lesions sporulate and new secondary infections occur.
Plasmopara viticola es un oomiceto de la familia de los peronosporáceos, responsable del mildio o mildiú de la vid. Es un parásito en sentido estricto, por lo que no es posible cultivarlo en laboratorio en medios sintéticos.
El ciclo de vida de este protista es tremendamente complejo. Durante el invierno sobrevive en una estructura conocida con el nombre de oospora o bien si el invierno es suave en forma de micelio dentro de las yemas o en las hojas persistentes de la vid (Vitis vinifera). Cuando se alcanza una temperatura ambiental que ronda los 12 °C, la oospora germina y forma un esporangio, que puede ser dispersado a través del viento. Para que un esporangio germine es necesario la presencia de lluvia, dado que son zoosporas las resultantes de esta germinación.
Debido a la movilidad de las zoosporas, este es el periodo de más peligro para el cultivo. Si las condiciones son las adecuadas —lluvia y una temperatura media de 12 °C— las zoosporas se disponen cerca de los estomas de la planta, se enquistan y forman un tubo germinal que se introduce a través del estoma. Este tubo germinal se desarrolla en la cavidad subestomática dando lugar a las primeras hifas que continuarán con la invasión del huésped. Cabe mencionar que estas hifas no están tabicadas, por lo que dicha hifa es un sincitio y por lo que se le considera un organismo unicelular.
P. viticola presenta una gran especificidad por su huésped, de tal forma que es imprescindible para este que sea vid y no otro tipo de planta, para que se desarrolle la infección. Una vez dentro de la vid, este protista se alimenta de esta mediante la formación de Haustorios.Tras el desarrollo del micelio y cuando las condiciones son las adecuadas, el protista vuelve a formar zoosporangios, muy ramificados, que salen a través de los estomas. Los esporangios se desprenden enteros con las zoósporas en su interior. Cuando están maduras salen al exterior causando un esparcimiento de zoosporas en el viñedo. Cuando las condiciones climáticas empeoran para el protista, se forman los gametangios a partir del micelio: se diferencian el oogonio femenino y el anteridio masculino, produciéndose por tanto la fase de reproducción sexual. Un núcleo meiótico del anteridio fecundará a una ovocélula dentro del oogonio y resultará una oospora de estructura resistente, con pared gruesa, que pasa el invierno en el suelo o dentro del huésped.
Del ciclo de vida de este protista se deduce que es muy dependiente de las condiciones climáticas y en general necesita primaveras húmedas y templadas, así como veranos cálidos y con frecuentes tormentas.
En cuanto a la clasificación taxonómica de este grupo decir que es compleja puesto que hasta hace poco se los ha clasificado en el Reino Fungi. Una característica fundamental de este grupo de organismo es que contienen muy poca quitina en la pared celular(a veces no poseen), dicho grupo se denomina Oomycota.
Este patógeno produce una sintomatología muy determinada. Este protista es un endoparásito, por lo que no se ven estructuras visibles hasta que la infección ha dañado de forma grave al huésped, pero no de forma irreparable. P. viticola es un patógeno que afecta a la parte aérea de la vid, pero lo más característico es un ataque a la hoja. En la hoja aparecen regiones de aspecto amarillento que se conocen con el nombre de "manchas de aceite" (este estadio es el que se puede observar en la imagen). Estas manchas de aceite son típicas del haz de la hoja, en el envés se observa, si el tiempo es húmedo, el típico "polvo de azúcar", que corresponde con la reproducción asexual, es decir, con los zoosporangios que salen a través de los estomas. En esta fase se puede confundir el ataque de P. viticola con el ataque de [Uncinula necator], responsable del oídio. La diferencia radica en que si se raspa el polvo de azúcar aparecen las manchas de aceite, mientras que con el oidio esto no ocurre. Si el ataque de P. viticola es fuerte, se produce una desecación parcial de la hoja que puede llevar a su caída prematura, lo que afecta a la producción. Conforme entra el otoño la mancha de aceite se vuelve en tonalidades mosaico (de amarillo a marrón). En regiones cercanas a la floración aparece una curvatura en forma de 'S' y el raquis del racimo se oscurece. Si el tiempo es húmedo se recubre de una "pelusilla blanca". Si el ataque acontece en los periodos de floración-cuajado puede producirse la pérdida total del racimo, mientras que si el ataque es más tardío, el ataque sólo afectará a una parte del racimo. Nunca se ve ataque tras el envero del racimo.
En el racimo se manifiesta de varios modos, los granos pierden fuerza y se caen, de forma parecida al ataque de la polilla de racimo (lobesia botrana), otro modo es el "asocarramiento" de la punta del racimo, los granos de la punta del racimo, incluyendo la raspa, quedan secos, como quemados, estando todo el racimo completamente sano. Cuanto más desarrollada está la uva menos vulnerable es a esta enfermedad.
P. viticola es originaria del continente americano, en donde se ha dado una coevolución huésped-patógeno que ha permitido que las variedades de vid de este continente sean más resistentes a la infección de este patógeno. No obstante las variedades europeas de vid no tuvieron contacto con dicho patógeno por lo que no tenían sistemas de protección contra este. En el siglo XIX los ingleses y franceses importan un terrible patógeno de la vid que arrasa con los cultivos de vid europeos en menos de treinta años. El organismo responsable de este desastre se le conoce con el nombre de filoxera (Dactylosphaera vitifoliae), un hemíptero que ataca a la raíz.
En 1878, los franceses idean una forma de evitar la filoxera que consiste en la importación de tallos de vides americanas sobre las cuales se realizan injertos de Vitis vinifera. Debido a la evolución huésped-patógeno, las variedades americanas son más resistentes al ataque de filoxera y se recuperó la producción europea de uva. No obstante, esto provocó la importación de P. viticola lo cual llevó al consiguiente desastre, puesto que los injertos de V. vinifera eran muy sensibles a este patógeno. La solución a este mal llegó más rápido que el de la filoxera. En 1885, un científico francés llamado Alexis Millardet paseaba por la campiña francesa cuando observó viñedos muy afectados por mildiú, sin embargo varias hileras próximas al sendero no lo estaban. Estas filas estaban empapadas de una sustancia de color azul y le preguntó al agricultor por la sustancia. El agricultor estaba cansado de que le robaran las uvas y las roció con esta sustancia que da un mal sabor a las uvas. Millardet experimentó con la sustancia - constituida por sulfato de cobre y cal viva- y demostró que se trataba de un excelente fungicida. A esta mezcla se la conoce con el nombre de mezcla bordelesa o caldo bordelés. El uso de fungicidas químicos derivados de este están muy difundidos como agentes que previenen la infección, ya que este caldo no tiene propiedades curativas
Plasmopara viticola es un oomiceto de la familia de los peronosporáceos, responsable del mildio o mildiú de la vid. Es un parásito en sentido estricto, por lo que no es posible cultivarlo en laboratorio en medios sintéticos.
El ciclo de vida de este protista es tremendamente complejo. Durante el invierno sobrevive en una estructura conocida con el nombre de oospora o bien si el invierno es suave en forma de micelio dentro de las yemas o en las hojas persistentes de la vid (Vitis vinifera). Cuando se alcanza una temperatura ambiental que ronda los 12 °C, la oospora germina y forma un esporangio, que puede ser dispersado a través del viento. Para que un esporangio germine es necesario la presencia de lluvia, dado que son zoosporas las resultantes de esta germinación.
Debido a la movilidad de las zoosporas, este es el periodo de más peligro para el cultivo. Si las condiciones son las adecuadas —lluvia y una temperatura media de 12 °C— las zoosporas se disponen cerca de los estomas de la planta, se enquistan y forman un tubo germinal que se introduce a través del estoma. Este tubo germinal se desarrolla en la cavidad subestomática dando lugar a las primeras hifas que continuarán con la invasión del huésped. Cabe mencionar que estas hifas no están tabicadas, por lo que dicha hifa es un sincitio y por lo que se le considera un organismo unicelular.
P. viticola presenta una gran especificidad por su huésped, de tal forma que es imprescindible para este que sea vid y no otro tipo de planta, para que se desarrolle la infección. Una vez dentro de la vid, este protista se alimenta de esta mediante la formación de Haustorios.Tras el desarrollo del micelio y cuando las condiciones son las adecuadas, el protista vuelve a formar zoosporangios, muy ramificados, que salen a través de los estomas. Los esporangios se desprenden enteros con las zoósporas en su interior. Cuando están maduras salen al exterior causando un esparcimiento de zoosporas en el viñedo. Cuando las condiciones climáticas empeoran para el protista, se forman los gametangios a partir del micelio: se diferencian el oogonio femenino y el anteridio masculino, produciéndose por tanto la fase de reproducción sexual. Un núcleo meiótico del anteridio fecundará a una ovocélula dentro del oogonio y resultará una oospora de estructura resistente, con pared gruesa, que pasa el invierno en el suelo o dentro del huésped.
Del ciclo de vida de este protista se deduce que es muy dependiente de las condiciones climáticas y en general necesita primaveras húmedas y templadas, así como veranos cálidos y con frecuentes tormentas.
En cuanto a la clasificación taxonómica de este grupo decir que es compleja puesto que hasta hace poco se los ha clasificado en el Reino Fungi. Una característica fundamental de este grupo de organismo es que contienen muy poca quitina en la pared celular(a veces no poseen), dicho grupo se denomina Oomycota.
Plasmopara viticola est un pseudochampignon de la famille des Peronosporaceae de la classe des Oomycetes. Il existe sous la forme de spores libres ou de mycélium ne pouvant croître qu'à l'intérieur des tissus de la vigne qu'il parasite. C'est l'agent pathogène du mildiou de la vigne. Il est signalé en Europe pour la première fois en Aquitaine en 1878[1], importé du continent américain.
Étymologie : le terme Plasmopara se décompose[2] en plasmo- (représentant plasmode « structure à plusieurs noyaux », du latin plasma- « forme, figure » + suffixe -ode « semblable ») et -para forme féminine en latin scientifique de -pare. Le terme viticola emprunté au latin viticola « vigneron ».
Avant 1845, les vignes européennes (Vitis vinifera) ne connaissaient ni oïdium, ni phylloxera et ni non plus de mildiou. En quelques décennies pourtant, ces maladies venues d'Amérique du Nord ravagèrent le vignoble européen : l'oïdium arriva en 1845, le phylloxera en 1861-1863 et le mildiou de la vigne suivit en 1878[3]. Planchon fut le premier à le détecter dans le Sud-Ouest puis on le trouva dans la région de Lyon, en Italie et en Suisse.
L'agent du mildiou de la vigne avait été décrit sous le nom de Botrytis viticola par Berkeley et Curtis en 1848. Mais l'élucidation du mode d'action de ce pathogène fut accomplie par un microbiologiste allemand, Anton de Bary en 1863. Ce grand pionnier de l'étude des champignons avait notamment découvert le cycle de développement sexuel de l'oomycète Phytophthora infestans provoquant le mildiou de la pomme de terre. De Bary décrivit aussi les cycles sexuel et asexuel du mildiou de la vigne[4] et plaça le pathogène responsable sous le genre Peronospora soit avec le nom d'espèce Peronospora viticola (De Bary 1863).
Vingt cinq ans plus tard, Berlese et De Toni (1888) reclassèrent l'agent du mildiou de la vigne dans le genre Plasmopara. Ce dernier produit des sporocystes (ou sporanges) dans lesquels les zoospores diploïdes sont produites, alors que les Peronospora germent par des tubes de germination (conidies).
Enfin, le dernier grand remaniement vient des études de phylogénétique[5] qui ont extrait les oomycètes du règne des champignons (Fungi) pour les placer dans les Bikonta, division des Stramenopiles (ou hétérocontes).
Plasmopara viticola est un endoparasite obligatoire qui se développe uniquement dans les tissus verts de la vigne et en particulier dans le parenchyme des feuilles[6]. Il vit aux dépens des tissus qu'il parasite et qu'il finit par détruire. On est actuellement incapable de le cultiver sur un milieu synthétique[7]. Au cours de son cycle de développement, Plasmopara viticola reste essentiellement sous forme diploïde. S'il est bien capable de fécondation croisée entre filaments mycéliens de type génétique différents[8], les gamètes (haploïdes) restent toujours à l'intérieur de formations mycéliennes, nommées gamétocystes.
P. viticola se caractérise aussi par le fait que les filaments de son mycélium n'ont pas de cloisons, que la paroi est cellulosique (à la différence des Eumycètes qui contiennent de la chitine) et que les zoospores sont biflagellées. Le passage par l'état filamenteux de son mycélium et son hétérotrophie le rapprochent certes des vrais champignons (Eumycètes) mais c'est le résultat d'une convergence évolutive. Son classement phylogénétique le place parmi les Oomycètes, plus proches des algues brunes et des diatomées que des « vrais champignons » Eumycètes[5].
P. viticola est une espèce endémique sur les espèces sauvages de Vitis d'Amérique du Nord[4]. Aussi les différentes espèces nord-américaines sont-elles devenues plus ou moins résistantes : Vitis rupestris est moyennement résistante et Vitis rotundifolia (ou muscadine) est résistante[9]. Par contre, la vigne européenne (Vitis vinifera cultivée) qui a longtemps évolué hors de tout contact avec ce pathogène, est très sensible.
Le pseudochampignon P. viticola se manifeste sous trois formes différentes au cours de son cycle de développement. Il passe par les stades oospores, zoospores et mycélium et leurs fructifications respectives (ou sporocystes). Les spores possèdent leur propre réserve énergétique interne. L'oospore est un œuf, obtenu par croisement "sexué" entre deux thalles (croisement hétérothallique). La zoospore est une spore munie de deux flagelles lui servant à se mouvoir dans le mince film d'eau à la surface des tissus végétaux. Ces deux types de spores puisent dans leur propre réserve énergétique pour croître ou se déplacer. Par contre, le mycélium se développe obligatoirement à l'intérieur des tissus de la vigne. Il se nourrit uniquement aux dépens des cellules végétales de la vigne avec pour conséquence des lésions tissulaires pouvant occasionner éventuellement des pertes de récolte importantes.
Le développement de Plasmopara viticola se fait suivant deux cycles imbriqués[4] :
Dans une section ci-dessous, chaque étape de ces deux cycles de reproduction est détaillée et illustrée plus abondamment (voir cadre jaune).
Les oospores sont des œufs formées à l'intérieur des tissus de la vigne au cours de l'automne. Après la chute des feuilles, ils survivent dans la litière au sol.
Au printemps, lorsque la température dépasse le 12 °C, les oospores germent et donnent naissance à de nombreuses zoospores. À l'occasion de pluies printanières, les zoospores sont projetées par les éclaboussures d'eau sur les organes aériens de la vigne les plus proches du sol[7]. Les zoospores migrent alors vers les stomates, perdent leurs flagelles et émettent un promycélium qui pénètre le limbe. Celui-ci produit de nombreux hyphes mycéliens qui s'infiltrent entre les cellules, envahissent complètement une zone de tissus et provoquent une lésion locale.
Sur les feuilles, apparaissent deux formes de lésions :
Sur les jeunes rameaux, apparaissent des lésions superficielles longitudinales, de couleur brune, pouvant provoquer une déformation de la tige. Des fructifications de P. viticola peuvent aussi sortir du rameau.
Les inflorescences et les baies du raisin sont aussi sensibles au mildiou. Des sporocystophores peuvent aussi s'y développer. Les baies affectées plus tardivement présentent des taches brunes à noirâtres, déprimées (en « coup de pouce »), non fructifères. On parle dans ce cas de « rot brun ».
Ainsi au printemps, une oospore de l'année passée, germe et donne de nombreuses zoospores qui vont contaminer les tissus de la vigne. Lors de cette infection primaire, le mycélium dense qui se développe à l'intérieur des tissus, produit des suçoirs (ou hausterium) qui vident les cellules de l'hôte de leurs nutriments et de leur eau. Le mildiou se développe toujours à partir de ces foyers primaires d'infection. Ces foyers primaires apparaissent pratiquement toujours aux mêmes endroits dans un vignoble et ont une extension limitée[10].
De ces lésions naissent des fructifications extérieures, nommées des sporocystophores (ou sporangiophores, apparaissant sous forme de feutrage blanc) qui à maturité, libèrent de nombreuses zoospores. Celles-ci par le même processus de dispersion-pénétration envahissent des zones saines des tissus et réalisent des infections secondaires.
La température et l'humidité affectent le développement de P. viticola. Depuis longtemps, les viticulteurs ont observé qu'il apprécie les périodes pluvieuses et les températures douces. En prévention, il est recommandé d'aérer la zone fructifère et d'empêcher la formation des mouillères dues à un excès d’eau dans la parcelle[11].
Reprenons plus précisément, le cycle de développement de P. viticola. Il se décompose en :
Enveloppées dans une double paroi robuste[14], les oospores sont les seules structures de P. viticola capables de survivre à des conditions hivernales difficiles voire extrêmes, car elles peuvent supporter des températures de −20 °C. Les oospores commencent à être matures en novembre et le froid prolongera leur aptitude à germer pendant plusieurs mois.
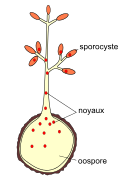
Oospore
2. Germination de l'oospore : au printemps suivant, lorsque le sol et l'atmosphère sont très humides et que la température atteint 12−13 °C, une partie des oospores sortent de leur dormance. L'oospore commence par produire des dizaines de noyaux diploïdes (obtenus par mitose) avant qu'émerge un tube germinatif[12]. Les noyaux migrent alors dans le tube jusque dans une ou plusieurs cavités piriformes, nommées sporocystes, (ou macrosporanges ou sporanges[N 1], ou macroconidies).Le taux de germination des oospores fluctue au cours du temps et à partir de mars, on observe un effet positif de la pluie sur le taux de germination[15]. Les oospores conservent même leur aptitude à germer plusieurs années[16].

Germination de l'oospore
3. Libération et dispersion des zoospores : les noyaux se multiplient par division mitotique, si bien que chaque sporocyste peut libérer de 60 à 200 spores mononuclées, appelées zoospores. Les éclaboussures de pluie et de terre occasionnées par les fortes précipitations dispersent les sporocystes et les zoospores sur les tissus de la vigne.Les zoospores se déplacent grâce à leurs deux flagelles dans le mince film d'eau à la face inférieure des feuilles et sur les baies, pour trouver un stomate dans lequel pénétrer. Les zoospores déposées sur une surface qui sèche rapidement, ne survivent pas. Contrairement aux oospores, leur durée de vie est très courte.

Libération des zoospores par un sporocyste
4. Germination du zoospore : quatre à cinq zoospores s’agglomèrent autour d'un stomate ouvert et perdent leurs flagelles. Elles émettent un tube germinatif (ou siphon infestant ou promycélium) qui pénètre le limbe de la feuille et conduit à la formation d'une vésicule sous-stomatique dans la cavité sous-stomatique[6].5. Infection primaire : le cytoplasme des zoospores est transmis à cette vésicule qui rapidement va émettre un haustorium (suçoir) primaire vers une cellule hôte. Cet inoculum primaire (ou infection primaire) marque le début du cycle agamique. Les premiers symptômes se manifestent une dizaine de jours après la contamination[7], ce qui correspond à la période d'incubation. Un mycélium se développe dans les espaces intercellulaires et s'alimente par des suçoirs (haustoria) qui pénètrent les cellules du parenchyme et de l'épiderme. Rapidement, ces haustoria secondaires pénètrent la paroi des cellules végétales pour pomper l'eau et les nutriments qu'elles contiennent. Les tissus lacuneux sont rapidement colonisés. Un corps sous-stomatal se développe et décolle le tissu épidermique du tissu parenchymateux, ce qui donne le symptôme de la « tache d'huile », une tache translucide apparaissant 4 à 5 jours après le début de l'infection. Le jaunissement de la feuille en raison de la perte de pigment chlorophyllien (du parenchyme palissadique) peut apparaître à partir du huitième jour après le début de l'infection.
Outre les infections primaires de début d’épidémie, Gobbin et al[17] ont montré que les infections primaires se prolongeaient tout au long de l’épidémie, à n'importe quel moment entre mai et août.
4. Germination de la zoospore. La nage de la zoospore jusqu'au stomate, la germination et la pénétration[4] se fait en 3 h à 20 °C.
5. Infection primaire : développement du mycélium
À cette étape, deux voies de reproduction s'ouvrent alors :
6a.2. Germination des sporocystes : après division mitotique des noyaux, les sporocystes libèrent 3 à 8 zoospores dans l'eau libre, 5 à 10 jours plus tard. Les conditions requises sont une température t> 13 °C (et température optimale de 19 °C) et une humidité de 98 %.
6a.3. Le cycle de reproduction asexuée est bouclé par une dispersion et une germination des zoospores dans un stomate (étape 4) et une infection (étape 5) qui cette fois est dite « secondaire ».
La sporulation marque le début d'un cycle secondaire : les zoospores sont dispersées par le vent pour atteindre et contaminer de nouvelles feuilles.

Sporulation : sortie de sporocystophores portant des sporocystes qui libèrent des zoospores. La sporulation se fait en 7 heures, dans le noir (elle est inhibée par la lumière[4]). Les zoospores se dispersent et provoquent une infection secondaire
Les travaux de Gobbin et als[17] (2008) ont montré que les contaminations secondaires par ce cycle asexué sont moins importantes que ce que l'on pensait antérieurement.
6b. Reproduction sexuée : 6b.1. Méiose : durant l'automne, au moment de la sénescence des feuilles, les filaments du mycélium de P. viticola forment des organes sexués (ou gamétocystes) dont la totalité de leur contenu évolue en gamètes par méiose. Le gamétocyste mâle[N 2],[8] (ou spermatocyste ou anthéridie) contient les gamètes mâles qui sont en fait réduits à un noyau haploïde et le gamétocyste femelle (ou oogone) contient des oosphères renfermant un noyau femelle haploïde et des réserves. Deux gamétocystes provenant de mycéliums génétiquement différents s'accolent alors l'un à l'autre (croisement hétérothallique, Wong et al.[8]).6b.2 Des tubes copulateurs partent des spermatocystes et pénètrent l'oogone pour permettre aux noyaux mâles d'aller féconder les gamètes femelles. Il n'y a pas de gamètes libérés à l'extérieur puisque les fécondations se produisent dans l'oogone.
6b.3 Formation des oospores : la fécondation se fait à l'intérieur de l'oogone. Celle-ci produit un zygote ou oospore.
6b.4 Libération des oospores. Cette étape ferme le cycle sexuel par un retour à l'étape 1. Même sous les conditions de température et d'humidité optimales, les oospores ne germent pas avant janvier-février. Le cycle de la reproduction sexuée se fait sur une année alors que celui de la reproduction asexuée se fait en un temps beaucoup plus court durant la saison végétative.
Ce mode de reproduction appelé oogamie siphonogamme est caractéristique des Oomycètes.

La lutte contre le mildiou s'organise principalement par des mesures préventives. Car s'il est possible de stopper une attaque, les dégâts une fois occasionnés sur les inflorescences et les grappes, sont par contre irrémédiables.
Quelques précautions sont importantes pour éviter l'installation de foyers primaires pouvant provenir d'oospores ayant passé l'hiver au niveau du sol et qui après germination produisent des zoospores contaminantes[10] :
La pulvérisation de fongicides anti-mildiou se fait d'abord de manière préventive sur les organes sains pour éviter leur infection. Pour décider du moment opportun et éviter des traitements inutiles, le viticulteur peut s'aider de systèmes d'aide à la décision ou prendre conseil auprès de techniciens. Empiriquement, on sait que le risque d'une germination précoce des oospores correspond à une période automne-hiver-printemps douce et pluvieuse. Une autre règle empirique[18] dites des "3-10" indique qu'une infection primaire est importante si :
Pendant la période de croissance de la vigne, il faut ensuite procéder à des pulvérisations régulières de fongicides en fonction de la vitesse de croissance de la végétation, de la fréquence des pluies, de la température et de la pression parasitaire[13]. Depuis deux décennies, de nombreux modèles d'aide à la décision ont été proposés. Le modèle de Caffi et al. (2009)[18] est un modèle systémique qui intègre l'influence de la pluviométrie, de l'humidité relative, de la température sur la maturation d'une cohorte d'œufs d'hiver, leur germination, leur production de sporocystes, et la libération et la dispersion des zoospores. Le modèle "Potentiel Systèmes" calcule, en fonction des données météorologiques recueillies sur différents secteurs du vignoble, des variables représentant principalement la maturité des œufs d'hiver, la pression exercée par diverses maladies et les dates de contamination.
Le traitement fongicide traditionnel mis au point à la fin du XIXe siècle était la bouillie bordelaise. Ce fut le seul produit utilisé jusqu'au milieu du XXe siècle mais il fut ensuite rapidement supplanté par les fongicides de synthèse. Actuellement, une pléthore de fongicides anti-mildiou sont proposés. On peut les classer en trois grandes classes : les produits de contacts, les produits pénétrants et les systémiques.
Plasmopara viticola est un pseudochampignon de la famille des Peronosporaceae de la classe des Oomycetes. Il existe sous la forme de spores libres ou de mycélium ne pouvant croître qu'à l'intérieur des tissus de la vigne qu'il parasite. C'est l'agent pathogène du mildiou de la vigne. Il est signalé en Europe pour la première fois en Aquitaine en 1878, importé du continent américain.
Peronospora (lat. Plasmopara viticola) je bolest vinove loze koju uzrokuje gljivica. Bolest je prenesena iz Sjeverne Amerike krajem 19. stoljeća i to podlogama koje su se koristile za razmnožavanje europske vrste loze (Vitis vinifera). Preduvjeti za ovu bolest, koji su najčešći sredinom svibnja su temperatura tla 8°C u trajanju od minimalno 24 sata, oborine i vlaga na listu u trajanju minimalno 4 do 6 sati, te listić promjera 5-10 cm. Peronospora napada sve organe vinove loze. Najkarakterističniji simptomi se javljaju na lišću, cvijetovima i grozdovima. Na lišću se pokazuju kao lako prozirne pjege, a u njima se s naličja za vlažnog vremena stvara bjeličasta paperjasta prevlaka. Na grozdovima je peronospora uočljiva od zametanja pa do šaranja bobica. Zaražene bobice prvo dobivaju plavičastu, a zatim zagasitu boju, smežuravaju se i sasušuju[1].
U Europu je ova bolest prenesena iz Amerike oko 1874. godine, a u Hrvatskoj je u nekim vinogorjima zapažena 1882. Jedna je od najštetnijih bolesti u vinogradarstvu čitavog svijeta. Svake godine, u našoj kao i u ostalim zemljama, nanosi osjetne gubitke, a u godinama peronospore može i pored primjene zaštitnih mjera upropastiti najveći dio berbe te ozbiljno iscrpiti lozu uslijed masovnog uništavanja lišća. Tretira se kemijskim sredstvima.
Peronospora je heterotrofni organizam i endoparazit tj. njezino se vegetativno tijelo (hife odnosno micelij) nalaze u unutrašnjosti lista, bobe i izboja. To jedna od najopasnijih bolesti vinove loze. Europska loza (Vitis vinifera), odnosno plemenita loza neće donijeti urod ako je ne zaštitimo od peronospore.
Peronospora (lat. Plasmopara viticola) je bolest vinove loze koju uzrokuje gljivica. Bolest je prenesena iz Sjeverne Amerike krajem 19. stoljeća i to podlogama koje su se koristile za razmnožavanje europske vrste loze (Vitis vinifera). Preduvjeti za ovu bolest, koji su najčešći sredinom svibnja su temperatura tla 8°C u trajanju od minimalno 24 sata, oborine i vlaga na listu u trajanju minimalno 4 do 6 sati, te listić promjera 5-10 cm. Peronospora napada sve organe vinove loze. Najkarakterističniji simptomi se javljaju na lišću, cvijetovima i grozdovima. Na lišću se pokazuju kao lako prozirne pjege, a u njima se s naličja za vlažnog vremena stvara bjeličasta paperjasta prevlaka. Na grozdovima je peronospora uočljiva od zametanja pa do šaranja bobica. Zaražene bobice prvo dobivaju plavičastu, a zatim zagasitu boju, smežuravaju se i sasušuju.
U Europu je ova bolest prenesena iz Amerike oko 1874. godine, a u Hrvatskoj je u nekim vinogorjima zapažena 1882. Jedna je od najštetnijih bolesti u vinogradarstvu čitavog svijeta. Svake godine, u našoj kao i u ostalim zemljama, nanosi osjetne gubitke, a u godinama peronospore može i pored primjene zaštitnih mjera upropastiti najveći dio berbe te ozbiljno iscrpiti lozu uslijed masovnog uništavanja lišća. Tretira se kemijskim sredstvima.
Peronospora je heterotrofni organizam i endoparazit tj. njezino se vegetativno tijelo (hife odnosno micelij) nalaze u unutrašnjosti lista, bobe i izboja. To jedna od najopasnijih bolesti vinove loze. Europska loza (Vitis vinifera), odnosno plemenita loza neće donijeti urod ako je ne zaštitimo od peronospore.
Plasmopara viticola adalah patogen tanaman.
Plasmopara viticola tumbuh bergerombol pada buah anggur. Pada tahun 1870, Plasmopara viticola menyerang seluruh kebun anggur di Prancis.
Plasmopara viticola adalah patogen tanaman.
Plasmopara viticola tumbuh bergerombol pada buah anggur. Pada tahun 1870, Plasmopara viticola menyerang seluruh kebun anggur di Prancis.
Plasmopara viticola[1] (Berk. & M.A. Curtis) Berl. & De Toni, 1888 è un microrganismo appartenente alla classe degli oomiceti, originario dell'America e importato accidentalmente in Francia intorno al 1878, da cui si è poi diffuso in tutta Europa.[2]
La Plasmopara viticola causa una tipica malattia della vite chiamata peronospora della vite, a ciclo fortemente condizionato delle condizioni climatiche, ed è oggi una delle più diffuse e pericolose malattie della vite in molte regioni europee ed italiane.
Le oospore si formano durante l'intero periodo vegetativo in seguito alla fecondazione di un oogonio (organo femminile) da parte di un anteridio (organo maschile). Durante l'inverno le oospore, che raggiungono la maturità in autunno, rimangono dormienti e la loro germinazione in primavera è influenzata principalmente dalle condizioni di temperatura e dalle precipitazioni.
Le oospore emettono lo sporangio piriforme contenente le zoospore responsabili delle infezioni primarie generalmente quando vengono soddisfatte le seguenti condizioni (regola dei tre dieci):
Le zoospore sono prive di parete e provviste di una coppia di flagelli che usano per muoversi nel velo d'acqua creatosi sulla vegetazione a seguito delle piogge. Giungono così in prossimità delle aperture stomatiche, dove si incistano, perdendo i flagelli e sviluppando la parete. Successivamente si ha l'emissione del tubetto germinativo, che penetra attraverso lo stoma.
Il periodo d'incubazione è l'intervallo che intercorre tra la penetrazione e la sporulazione - influenzato dalla temperatura e dall'umidità relativa - e varia dai 4 ai 23 giorni (tabella di Muller-Goidanich). Durante questo periodo il patogeno si sviluppa all'interno del mesofillo fogliare negli spazi intercellulari, emettendo austori a forma di bottone, che penetrano all'interno delle cellule per estrarne nutrimento.
Questa causa il disfacimento del tessuto fogliare che si manifesta, sulla pagina superiore delle foglie, con tipiche macchie circolari gialle dette comunemente "macchie d'olio".
A fine ciclo vitale, quando il patogeno non ha più nutrimento, durante le ore notturne, si avrà la fuoriuscita dei rami conidiofori sulla pagina inferiore solo quando le seguenti condizioni saranno soddisfatte per almeno 4 ore notturne:
La fuoriuscita degli sporangi dalle aperture stomatiche produce la caratteristica "muffa bianca".
La diffusione delle zoospore e l'inizio dei cicli di infezioni secondarie avviene tramite il vento o la pioggia. Quando una zoospora arriva su una foglia bagnata germina e avvia una nuova infezione.
Le variabili chiave per le infezioni secondarie sono la temperatura e la bagnatura fogliare e saranno possibili solo quando il loro prodotto arriva al valore di 50. Ciò sta a significare che ad una temperatura di 10 °C saranno necessarie 5 ore di bagnatura pena la morte delle zoospore.
Le foglie molto colpite si necrotizzano e cadono precocemente.
Le infiorescenze sono estremamente sensibili al patogeno. Prima e durante la fase di fioritura i grappolini colpiti si ingialliscono assumono una tipica forma ad "S" e disseccano.
Nel grappolo tra la fase d'allegagione e di chiusura dei grappoli, in condizioni di bassa umidità relativa si ha la manifestazione della forma larvata senza fuoriuscita dei rami conidiofori ma solo con l'imbrunimento e disseccamento parziale o totale di acini e grappoli che solitamente assumono una forma ad uncino.
A fine stagione è possibile soprattutto sulle femminelle che in presenza di condizioni favorevoli ci siano attacchi che possono in qualche misura rallentare o compromettere la maturazione dei grappoli.
Il principio attivo tradizionale per la lotta a questo patogeno fungino è il rame, disponibile in diverse forme (fungicidi rameici), tra i quali si ricorda la poltiglia bordolese, il più tradizionale e antico rimedio alla peronospora della vite.
I fungicidi rameici sono attualmente gli unici fungicidi ammessi in agricoltura biologica per il contenimento della peronospora. Hanno però lo svantaggio che si tratta di prodotti di copertura (ovvero non sono preparati di tipo sistemico), a prevenzione dell'infezione, e quindi è necessario ripristinare le coperture con il prodotto ad ogni precipitazione e possono solo contenere una infezione già in corso ma non curarla. Oltretutto il rame, metallo poco mobile, tende ad accumularsi nel suolo causando problemi di inquinamento del terreno che possono determinare fitotossicità e stentato sviluppo delle radici delle piante: l'Unione europea ha infatti stabilito un tetto massimo annuale di 4 kg/ettaro di rame.
Nonostante questi inconvenienti i sali di rame sono tuttora molto usati, soprattutto dopo l'invaiatura o con buone condizioni climatiche (precipitazioni scarse o temperature superiori ai 30-33 gradi), quando la pressione del patogeno è solitamente più bassa.
Dal dopoguerra ad oggi comunque sono stati introdotti un gran numero di principi attivi per la lotta peronosporica, anche con prodotti citotropici e sistemici che oltre a prevenire l'infezione hanno anche effetti curativi ed eradicanti. Tra questi si possono ricordare:
La maggior parte di principi attivi, oltre all'effetto curativo/eradicante, hanno il vantaggio di una maggiore resistenza al dilavamento; per contro, bisogna prestare attenzione a non utilizzare lo stesso principio attivo, o principi attivi appartenenti alla stessa famiglia chimica, per più di 3 trattamenti all'anno (4 per alcuni principi attivi) per non far sorgere nel patogeno fenomeni di resistenza e adattamento, cosa che non si verifica con i prodotti rameici.
Plasmopara viticola (Berk. & M.A. Curtis) Berl. & De Toni, 1888 è un microrganismo appartenente alla classe degli oomiceti, originario dell'America e importato accidentalmente in Francia intorno al 1878, da cui si è poi diffuso in tutta Europa.
La Plasmopara viticola causa una tipica malattia della vite chiamata peronospora della vite, a ciclo fortemente condizionato delle condizioni climatiche, ed è oggi una delle più diffuse e pericolose malattie della vite in molte regioni europee ed italiane.
Plasmopara viticola – gatunek lęgniowca z rodziny wroślikowatych[1]. W polskiej literaturze znany pod nazwą drzewik[2] lub drzewnik[3].
Pozycja w klasyfikacji według Index Fungorum: Plasmopara, Peronosporaceae, Peronosporales, Peronosporidae, Peronosporea, Incertae sedis, Oomycota, Chromista[1].
Po raz pierwszy zdiagnozowali go w 1848 r. M.J. Berkeley i M.A. Curtis) nadając mu nazwę Botrytis viticola. Obecną, uznaną przez Index Fungorum nazwę nadali mu Berl. i De Toni w 1888 r[1].
Jest pasożytem winorośli żyjącym wewnątrz jej tkanek. Przez aparaty szparkowe wypuszcza strzępki zakończone konidiami. Konidia są roznoszone przez wiatr i trafiając na suche tkanki wrastają w nie, a trafiając na warunki wilgotne wytwarzają zoospory. Choroba wywoływana przez drzewika to mączniak rzekomy winorośli[2].
Rozmnażanie płciowe przebiega na drodze oogamii. Proces ten zachodzi wewnątrz blaszki liściowej winorośli i jest poprzedzony wytworzeniem na strzępkach organów płciowych: lęgni i plemni. Zapłodnienie polega na połączeniu się jądra męskiego z jądrem żeńskim. Jądro męskie jest przenoszone z plemni do lęgni za pomocą strzępki zapładniającej. W czasie opisanego procesu trwa dikariofaza. Powstała w ten sposób oospora może zimować lub w łagodnym klimacie już jesienią tworzyć twór przypominający grzybnię. Zwykle kiełkuje wiosną, przy temperaturze 10 °C w wilgotnej glebie. Na szczycie strzępki powstaje makrosporangium uwalniające zwykle 8–20 (czasem do 60) zoospor, które są w stanie w wilgotnych warunkach infekować rośliny przez aparaty szparkowe. Wewnątrz liścia zoospory kiełkują w plechę, która przerasta jego tkanki i wytwarza kolejne zoospory[5].
Plasmopara viticola – gatunek lęgniowca z rodziny wroślikowatych. W polskiej literaturze znany pod nazwą drzewik lub drzewnik.