en
names in breadcrumbs


Drosophila mature through complete metamorphosis, as do all members of the order Diptera.
Similar to all insects Drosophila is covered in a chitinous exoskeleton; has three main body segments; and has three pairs of segmented legs.
Adult: The common fruit fly is normally a yellow brown (tan) color, and is only about 3 mm in length and 2 mm in width (Manning 1999, Patterson, et al 1943). The shape of the common fruit fly's body is what one would normally imagine for a species of the order Diptera. It has a rounded head with large, red, compound eyes; three smaller simple eyes, and short antennae. Its mouth has developed for sopping up liquids (Patterson and Stone 1952). The female is slightly larger than the male (Patterson, et al 1943). There are black stripes on the dorsal surface of its abdomen, which can be used to determine the sex of an individual. Males have a greater amount of black pigmentation concentrated at the posterior end of the abdomen (Patterson and Stone 1952).
Like other flies, Drosophila macquarti has a single pair of wings that form from the middle segment of its thorax. Out of the last segment of its throax (which in other insects contains a second pair of wings) develops a set rudimentry wings that act as knobby balancing organs. These balancing organs are called halteres. (Raven and Johnson 1999)
Larvae are minute white maggots lacking legs and a defined head.
Other Physical Features: ectothermic ; heterothermic ; bilateral symmetry
Sexual Dimorphism: female larger; sexes colored or patterned differently
Average lifespan
Status: captivity: 0.3 years.
Drosophila macquarti lives in a wide range of habitats. Native habitats include those in the tropical regions of the Old World, but the common fruit fly has been introduced to almost all temperate regions of the world. The only aspects that limit the habitats Drosopila melangaster can live in is temperature and availability of water. The scientific name Drosophila actually means "lover of dew", implying that this species requires moist environments.
The development of this species' offspring is extremely dependent on temperature, and the adults cannot withstand the colder temperatures of high elevations or high latitudes. Food supplies are also limited in these locations. Therefore, in colder climates Drosophila macquarti cannot survive.
In temperate regions where human activities have introduced Drosophila macquarti, these flies seek shelter in colder winter months. Many times Drosophila can be found in fruit cellars, or other available man made structures with a large supply of food.
Habitat Regions: temperate ; tropical ; terrestrial
Terrestrial Biomes: savanna or grassland ; chaparral ; forest ; rainforest ; scrub forest
Other Habitat Features: urban ; suburban ; agricultural
Drosophila macquarti has been introduced to every continent of the world with one exception, Antarctica. On other continents its range is limited only by mountain ranges, deserts, and high lattitudes. (Demerec 1950) The natural range of D. melanogaster is throughout the Old World tropics. Humans have helped to spread Drosophila macquarti to every other location which it inhabits.
Biogeographic Regions: nearctic (Introduced ); palearctic (Introduced ); oriental (Native ); ethiopian (Native ); neotropical (Introduced ); australian (Introduced ); oceanic islands (Introduced )
Other Geographic Terms: cosmopolitan
As the name implies, the fruit flies lives primarily on plant material. The adults thrive on rotting plants, and fruits; while eggs are usually laid on unripened/slightly ripened fruit, so by the time the larva develop the fruit will have just started to rot, and they can use the fruit that the egg was laid on as their primary source of nutrition. Drosophila are considered major pests in some area of the world for this reason.
Plant Foods: fruit
Primary Diet: herbivore (Frugivore )
This species is widely used in scientific research.
Positive Impacts: source of medicine or drug
Drosophila macquarti has been known to over winter in storage facilites, where it can consume/ruin vast quatities of food. As stated above, the fruit fly also lays its eggs on unripened fruit, and is considered a pest in many areas. (Demeric 1950, Wilson 1999)
US Federal List: no special status
CITES: no special status
Drosophila macquarti has been studied in genetic research laboratories for almost a century. Because the fruit fly has a short lifespan, a simple genome, and is easily made to reproduce in captivity it is a prime canidate for genetic research. (Patterson, et al., 1943)
In 1910 Thomas H. Morgan used Drosophila to provide the first proof that the chromosomal theory of inheritance is correct. The chromosomal theory of inheritance states that the chromosomes are the carriers of genetic information. Morgan was the first to use Drosophila in genetic reasearch.
In 1913 H. Sturtevant, a student of Morgan created the first genetic maps using Drosophila macquarti. Since that time the simple genome of Drosophila macquarti has become very well known, allowing for much of the progression of genetic research.
Drosophila is also widely used by students of biology. (Raven and Johnson 1999)
Reproduction in Drosophila is rapid. A single pair of flies can produce hundreds of offspring within a couple of weeks, and the offspring become sexually mature within one week (Lutz 1948).
As in all insect species Drosophila macquarti lays eggs. The eggs are placed on fruit, and hatch into fly larvae (maggots), which instantly start consuming the fruit on which they were laid (Patterson and Stone 1952).
Male flies have sex combs on their front legs. It has been theorized that these sex combs might be used for mating. However, when these combs are removed it seems to have little effect on mating sucess (Patterson, et al 1943).
Average age at sexual or reproductive maturity (female): 1 weeks.
Average age at sexual or reproductive maturity (male): 1 weeks.
Key Reproductive Features: semelparous ; year-round breeding ; sexual ; fertilization (Internal ); oviparous
Average age at sexual or reproductive maturity (male)
Sex: male: 7 days.
Average age at sexual or reproductive maturity (female)
Sex: female: 7 days.
D. melanogaster has a vital role in the ecosystem as an efficient vector for transfer of fungal and yeast species (Ashburner, eol.org). D. melanogaster is preyed upon by other arthropods, especially beetles and spiders (Markow, 2015; Hendrichs and Hendrichs, 1998) as well as vertebrates such as tree frogs, dart frogs, lizards and birds (Sivinski et al., 2001). The larvae of D. melanogaster are also at risk of predation by ants (Fernandes et al., 2012). It is reported that D. melanogaster are more prone to predation while engaging in courtship or sexual behaviors because they are more likely to be distracted and moving less frequently (Sivinski et al., 2001). D. melanogaster is considered a pest in many parts of the world, and because of this, some of the predator species mentioned above are commonly used as effective methods for their prevention and elimination. The D. melanogaster has not yet been assessed by the International Union for Conservation of Nature (IUCN).
The D. melanogaster species are herbivores and frugivores. In nature, they primarily feed on fermenting or rotting fruit or vegetables (Kohler, 1993), with yeast being the main appealing ingredient in these food sources (Becher et al., 2012). To find food, they are guided by receptors on the proboscis, wings and legs, that are responsible for smell and taste sensations (Montell, 2009). Because females lay eggs on fruit, the primary food source for larvae is the fruit itself (Reaume and Sokolowski, 2006). In the lab, the number of times a D. melanogaster eats throughout the day varies but it appears that females consume more food than males (Wong et al., 2009).
Drosophila melanogaster (Common fruit fly), a member of the order Diptera and family Drosophilidae, is a small, yellow-brown fly +with an average length of 3 mm (Miller, 2000). The native habitat of D. melanogaster consists of tropical and temperate climates of Africa, Europe and Asia (Miller, 2000). D. melanogaster are herbivores (frugivores) and eat decaying fruit and vegetables (Kohler, 1993). The life cycle of this species varies with temperature (Demerec and Kaufmann, 1957) and consists of 3 main stages: embryonic, larval and pupal. Adult male D. melanogaster can be differentiated from female D. melanogaster by their smaller size, the presence of sex combs and a darkened area at the end of the abdomen (Demerec and Kaufmann, 1957). The D. melanogaster is considered a model organism due to its small size, short life cycle, fast reproductive rate, low cost in maintenance, and a small (4 chromosomes) sequenced genome (Adams et al., 2000; Demerec and Kaufmann, 1957; Patterson, et al., 1943).
The development of D. melanogaster varies with temperature (Demerec and Kaufmann, 1957) and consists of 3 main stages: embryonic, larval and pupal. Reproduction in the oviparous D. melanogaster is fast (Lutz, 1948), beginning with internal fertilization followed by the female fly laying anywhere from 100 to 400 eggs (Kohler, 1993) on moist, fermenting food. This embryonic stage usually lasts for a day and is followed by the 1st, 2nd and 3rd instar larval stages, which spans 4 days total (Bainbridge, Bownes, 1981).The subsequent changes from prepupa to pupa stage takes about 5 days, after which the adult fly is formed (Bainbridge and Bownes, 1981). The average life expectancy of the D. melanogaster is between 40-60 days but depends on varying factors including environment and genetics (Ajjuri et al., 2015).
The typical pattern of morphological evolution associated with the radiation of a group of related species is the emergence of a novel trait and its subsequent diversification. Yet the genetic mechanisms associated with these two evolutionary steps are poorly characterized. Here, we show that a spot of dark pigment on fly wings emerged from the assembly of a novel gene regulatory module in which a set of pigmentation genes evolved to respond to a common transcriptional regulator determining their spatial distribution...
Drosophila melanogaster (literalmente "amante del rocío de vientre negro"), también llamada mosca del vinagre o mosca de la fruta, es una especie de díptero braquícero de la familia Drosophilidae. Recibe su nombre debido a que se alimenta de frutas en proceso de fermentación tales como manzanas, bananas, uvas, etc. Es una especie utilizada frecuentemente en experimentación genética, dado que posee un reducido número de cromosomas (4 pares), breve ciclo de vida (15-21 días) y aproximadamente el 61% de los genes de enfermedades humanas que se conocen tienen una contrapartida identificable en el genoma de las moscas de la fruta, y el 50% de las secuencias proteínicas de la mosca tiene análogos en los mamíferos.
Para propósitos de investigación, fácilmente pueden reemplazar a los humanos. Se reproducen rápidamente, de modo que se pueden estudiar muchas generaciones en un corto espacio de tiempo, y ya se conoce el mapa completo de su genoma. Fue adoptada como animal de experimentación genética por Thomas Morgan a principios del siglo XX. Sus 165Mb de genoma (1Mb = 1 millón de pares de bases) fueron publicados en marzo de 2000 gracias al consorcio público y la compañía Celera Genomics. Alberga alrededor de 13.600 genes.
The D. melanogaster has distinct characteristics that have made it an important model organism in modern genetics, biology, disease physiology, and ecology. These include, but are not limited to, its small size and genome, short life cycle, high reproduction rates, ease in culture and maintenance, and a complete sequenced genome (Adams et al., 2000; Demerec and Kaufmann, 1957; Patterson et al., 1943). A vast range of D. melanogaster mutants with varying physical characteristics exist to date and a large database of drosophila genome sequencing information is available. For more details, please visit flybase.org.
D. melanogaster are not a solitary species (Markow, 2015). Research has shown that they are active during the day but their level of movement decreases during the night, though it is not clear if this decrease is due to sleep or quiet waking (Cirelli and Bushey, 2008). Studies under laboratory conditions show wildD. melanogaster activity levels peak in the morning and evening, but observation in the field show an additional peak in activity during the afternoon, all of which appear to be temperature dependent (Vanin et al., 2012). During periods of cool temperatures, female D. melanogaster enter a reproductive diapause, a hibernation-like state that results in reduced ovarian development (Saunders et al., 1989).
The wild adult D. melanogaster is yellow brown (tan) in color, has a circular head and two large, red compound eyes (Miller, 2000). Between the two compound eyes are three simple eyes (ocelli) that help the D. melanogaster with sight, steering and movement (Sabat et al., 2016). Its average body size is 3 mm in length and 2 mm in width (Miller, 2000). Body size can vary with latitude and temperature (Azevedo et al., 1997; French et al., 1998). On average, female D. melanogaster tend to be heavier, with a mean dry mass range of 0.281 mg to 0.351 mg whereas the range for males is between 0.219 mg to 0.304 mg (Worthen, 1996). D. melanogaster has three pairs of legs and a three-segmented body, from which a pair of wings form (Miller, 2000). On various parts of the body, including the wings, legs and proboscis, D. melanogaster have receptors that help them identify food (Montell, 2009). They also have an exoskeleton that is composed of chitin. A short antenna on the drosophila helps detect air motion (Fuller et al., 2014) and also serves as a hearing device, which is a functional adaptation (Collins, 2004).
There are key differences that distinguish adult males from adult females. Adult males contain a visible darkened area in the posterior end of the abdomen, sex combs (black bristles) on the legs and a rounded abdomen with five segments (Demerec and Kaufmann, 1957). Females have seven abdominal segments, and lack sex combs and the black abdominal patch (Demerec and Kaufmann, 1957). The tip of the abdomen in females is more lengthened compared to the males (Demerec and Kaufmann, 1957) and they also tend to be larger in size (Patterson et al., 1943).
Courtship between the male and female D. melanogaster usually begins on the feeding site of a fruit (Markow, 1998) and involves tapping, wing vibrations, and acoustic signals (Greenspan and Ferveur, 2000). For males, mating becomes more selective with experience (Dukas, 2004; Saleem et al., 2014), while for females, the timing of mating has shown to be important in predicting reproductive success (Long et. al, 2010). Reproductive behavior in D. melanogaster differs in the wild compared to lab conditions. In both cases, size of the male plays a role, with higher reproductive success associated with larger males (Markow, 1998). Breeding occurs year-round, with females completing a reproductive cycle within 10 days to 3 weeks (Kohler, 1993). In lab conditions, both sexes are observed to mate by day 1 or 2 after reaching adulthood and it is noteworthy that females can also mate again after 5-7 days (Markow, 1982).
Drosophila melanogaster (en griegu significa lliteralmente «amigu de la rosada de banduyu negru»), tamién llamada mosca d'el vinagre o mosca de la fruta, ye una especie de dípteru braquícero de la familia Drosophilidae. Recibe'l so nome por cuenta de qu'aliméntase de frutes en procesu de fermentadura tales como mazanes, bananes, uves, etc. Ye una especie utilizada frecuentemente n'esperimentación xenética, yá que tien un amenorgáu númberu de cromosomes (4 pares), curtiu ciclu de vida (15-21 díes) y aproximao el 61 % de los xenes d'enfermedaes humanes que se conocen tienen una contrapartida identificable nel xenoma de les mosques de la fruta, y el 50 % de les secuencies proteíniques de la mosca tien análogos nos mamíferos.[2]
Pa propósitos d'investigación, fácilmente pueden reemplazar a los humanos. Reprodúcense rápido, de cuenta que pueden estudiase munches xeneraciones nun curtiu espaciu de tiempu, y yá se conoz el mapa completu del so xenoma. Foi adoptada como animal d'esperimentación xenética por Thomas Morgan a principios del sieglu XX. Los sos 165 Mb de xenoma (1 Mb = 1 millón de pares de bases) fueron publicaos en marzu de 2000 gracies al consorciu públicu y la compañía Celera Genomics.[3] Alluga alredor de 13.600 xenes.
D'una célula deriven célules fíes que xeneren una posible asimetría. Presenta una asimetría inicial na distribución de los sos componentes citoplasmáticos que da llugar a les sos diferencies de desenvolvimientu. Na ovogénesis xenérense célules foliculares, célules nodrizas y el ovocito. La mosca de la fruta, a 29 °C, algama a vivir 30 díes; y de güevu a adultu 7 díes.[4][5][6][4][5][7]
El desenvolvimientu ceo determina la formación d'exes.
El primordio desenvuelve diferencies nes exes: anteroposterior y dorsoventral.
Una socesión d'acontecimientos derivaos de l'asimetría inicial del cigotu traducir nel control de la espresión xénica de forma que les rexones distintes del güevu adquieren distintes propiedaes. Esto puede asoceder pola distinta localización de los factores de trescripción y traducción nel güevu o pol control diferencial de les actividaes d'estos factores.
Dempués sigue otra etapa na que se determinen les identidaes de les partes del embrión: defínense rexones de les que deriven partes concretes del cuerpu.
Los xenes que regulen el procesu codifican reguladores de la trescripción y actúen unos sobre otros de forma xerárquica. Tamién actúen sobre otros xenes que son los que verdaderamente encargar del establecimientu d'esti patrón (actúen en cascada).
Tamién hai que tener en cuenta les interacciones célula-célula yá que definen les fronteres ente los grupos celulares.
Hai 3 grupos de xenes en función de los sos efeutos sobre la estructura d'un segmentu:
La siguiente etapa del desenvolvimientu depende de los xenes que s'espresen na mosca madre. Estos xenes espresen antes de la fertilización. Pueden estremase en:
Esisten cuatro grupos de xenes qu'intervienen nel desenvolvimientu de les distintes partes del embrión. Cada grupu entamar nuna vía distinta que presenta un orde concretu d'actuación. Cada vía empecipiar con fechos que tien llugar fuera del güevu, lo que tien como resultáu la localización d'una señal dientro d'este. Estes señales (son proteínes que reciben el nome de morfógenos) distribuyir de forma asimétrica pa cumplir funciones distintes.
De la exa antero-posterior encárguense 3 sistemes y del envés-ventral encárgase unu:
Tolos componentes de los cuatro sistemes son maternos polo que los sistemes qu'establecen el patrón inicial dependen de sucesos anteriores a la fertilización.
Esiste una complexa interrellación ente oocito y célules foliculares (xenes del oocito son necesarios pal desenvolvimientu de célules foliculares y señales d'estes, tresmitíes al oocito, provoquen el desenvolvimientu d'estructures ventrales).
Otra vía encargar del desenvolvimientu dorsal mientres la crecedera del güevu.
Los sistemes funcionen pola activación d'una interacción amestando-receptor que desencadena una vía de transducción.
El procesu depende, nel so entamu, del xen Gurken (qu'actúa tamién en diferenciación antero-posterior). El mRNA de Gurken asítiase na cara posterior del oocito faciendo que les célules foliculares axacentes estremar en célules posteriores. Estes célules devuelven una señal que desencadena la producción d'una rede de microtúbulos que ye necesaria pa la polaridá.
La polaridá dorsoventral establezse cuando gurken llega a la cara dorsal del oocito (depende de la espresión de dellos xenes más).
El productu de Gurken actúa como amestando interaccionando col receptor (productu del xen Torpedu) d'una célula folicular.
L'activación d'esti receptor desencadena una vía de señalización que'l so efeutu final ye la torga a que se desenvuelva la cara ventral na dorsal (produzse un cambéu nes propiedaes de les célules foliculares d'esta cara).
El desenvolvimientu d'estructures ventrales rique xenes maternos qu'establecen la exa envés-ventral. El sistema dorsal ye necesariu pal desenvolvimientu d'estructures ventrales (como mesodermo y neuroectodermo). Mutaciones nél, torguen el desenvolvimientu ventral.
La vía del desenvolvimientu ventral, tamién s'empecipia nes célules foliculares y remata nel oocito. Nes célules foliculares prodúcense una serie de señales qu'acaben xenerando un amestando par el receptor (productu del xen Toll = primer componente de la vía, qu'actúa dientro del oocito).
Toll ye'l xen crucial nel tresporte de la señal al interior del oocito.
El restu de componentes del grupu dorsal codifican productos qu'o regulen o son necesarios pa l'acción de Toll. Toll ye una proteína transmembrana (homóloga al receptor de la interleuquina 1).
La unión de la so amestando al receptor Toll, activa la vía que determina'l desenvolvimientu ventral. La distribución del productu d'esti xen ye bien variable, pero solo induz la formación d'estructures ventrales en llugares fayadizos (paez que solo s'espresa productu activu en ciertes rexones).
Tres la unión del amestando, el receptor Toll activar na cara ventral del embrión. Esta activación desencadena nuna serie de procesos nos qu'intervienen los productos d'otros xenes y que termina na fosforilación del productu del xen cactus que ye'l regulador final del factor de trescripción del xen Dorsal.
Na citoplasma hai un complexu cactus-dorsal inactivu pero que al fosforilarse cactus llibera a la proteína dorsal, qu'entra nel nucleu.
L'activación de toll lleva a l'activación de dosal.
Establezse un gradiente de proteína dorsal nel nucleu que va del llau dorsal al ventral nel embrión. Na cara ventral, la proteína dorsal lliberar escontra'l nucleu pero na dorsal, permanez na citoplasma.
La proteína dorsal activa a los xenes Twist y Snail (necesarios pal desenvolvimientu d'estructures ventrales) y inhibe a los xenes Decapentaplegic y Zerknullt (necesarios pal desenvolvimientu d'estructures dorsales). La interacción inicial ente gurken y torpedu lleva a la represión de l'actividá de spatzle na cara dorsal del embrión (amestando de toll).
La proteína dorsal, asitiada nel nucleu, inhibe la espresión de dpp. D'esta miente, les estructures ventrales formar según un gradiente nuclear de la proteína dorsal y les estructures dorsales según un gradiente de la proteína dpp.
El xenoma de D. melanogaster (secuenciáu en 2000, y verificáu na base de datos FlyBase[3]) contién cuatro pares de cromosomes: un par X/Y, y trés autosomes señalaos como 2, 3, 4. El cuartu cromosoma ye tan pequeñu que dacuando s'ignora, salvo l'importante xen ensin güeyos. El xenoma secuenciáu de D. melanogaster de 139,5 millones de pares de bases[9] contién aproximao 15.016 xenes. Más del 60% del so xenoma ye funcional al codificar ADN non codificador de proteínes[10] arreyaos nel control de la espresión xénica. La determinación de sexu en Drosophila producir pola rellación de cromosomes X a autosomas, non por cuenta de la presencia d'un cromosoma Y como asocede na determinación de sexu n'humanos. Anque'l cromosoma Y ye dafechu heterocromática, contién siquier 16 xenes, munchos de los cualos cumplen funciones relatives al sexu macho.[11]
Cerca del 75% de xenes humanos venceyaos con enfermedaes, tienen el so homólogu nel xenoma de la mosca de la fruta,[12] y el 50% de les secuencies de proteínes de la mosca tien el so homólogu en mamíferos. Esiste una Base de Datos en llinia, llamada Homophila ta disponible pa estudios d'enfermedaes xenétiques humanes homólogues en mosques y viceversa.[13] Drosophila sigue siendo usáu estensamente como modelu xenéticu pa diverses enfermedaes humanes incluyendo a desordes neurodegenerativos Parkinson, Huntington, ataxia espinocerebelosa y Alzheimer. Esta mosca tamién s'usa n'estudios de mecanismos del avieyamientu y estrés oxidativo, sistema inmunitario, diabetes, cáncer, abusu de drogues.
Drosophila melanogaster (en griegu significa lliteralmente «amigu de la rosada de banduyu negru»), tamién llamada mosca d'el vinagre o mosca de la fruta, ye una especie de dípteru braquícero de la familia Drosophilidae. Recibe'l so nome por cuenta de qu'aliméntase de frutes en procesu de fermentadura tales como mazanes, bananes, uves, etc. Ye una especie utilizada frecuentemente n'esperimentación xenética, yá que tien un amenorgáu númberu de cromosomes (4 pares), curtiu ciclu de vida (15-21 díes) y aproximao el 61 % de los xenes d'enfermedaes humanes que se conocen tienen una contrapartida identificable nel xenoma de les mosques de la fruta, y el 50 % de les secuencies proteíniques de la mosca tien análogos nos mamíferos.
Pa propósitos d'investigación, fácilmente pueden reemplazar a los humanos. Reprodúcense rápido, de cuenta que pueden estudiase munches xeneraciones nun curtiu espaciu de tiempu, y yá se conoz el mapa completu del so xenoma. Foi adoptada como animal d'esperimentación xenética por Thomas Morgan a principios del sieglu XX. Los sos 165 Mb de xenoma (1 Mb = 1 millón de pares de bases) fueron publicaos en marzu de 2000 gracies al consorciu públicu y la compañía Celera Genomics. Alluga alredor de 13.600 xenes.
La mosca del vinagre o mosca de la fruita (Drosophila melanogaster, literalment "amant de la rosada de ventre negre") és una espècie dípter braquícer de la família dels drosofílids. S'usa sovint en experimentació genètica, atès que aproximadament el 61% dels gens de malalties humanes que es coneixen tenen una contrapartida identificable en el genoma de les mosques de la fruita, i el 50% de les seqüències proteiques de la mosca té anàlegs en els mamífers.
Per a propòsits d'investigació, fàcilment poden reemplaçar els humans. Proliferen ràpidament, de manera que moltes generacions poden ser estudiades en un curt temps, i ja es coneix el mapa complet del seu genoma. Va ser adoptada com a animal d'experimentació genètica per Thomas Hunt Morgan a principis del segle XX. Els seus 165 MB de genoma (1 MB = 1 milió de parells de bases) van ser publicats en març de l'any 2000 gràcies al consorci públic i la companyia Celera Genomics i contenen vora 13.600 gens.
Malgrat el seu ús en laboratoris, aquesta mosca es troba sovint a prop de les persones i pot proliferar preferentment sobre fruita madura o en descomposició inicial, i sobre líquids ensucrats o alcohòlics.
D'una cèl·lula en deriven cèl·lules filles que generen una possible asimetria. Presenta una asimetria inicial en la distribució dels seus components citoplasmàtics que dóna lloc a les seves diferències de desenvolupament. En l'oogènesi es generen cèl·lules fol·liculars, cèl·lules nodrizas i l'oòcit.
La mosca del vinagre, a 29 °C, arriba a viure 30 dies; i d'ou a adult 7 dies.[2][3][4][2][3]
El desenvolupament primerenc determina la formació d'eixos.
El primordi desenvolupa diferències en els eixos: anteroposterior, dorsoventral.
Una successió de fets derivats de l'asimetria inicial del zigot es tradueix en el control de l'expressió gènica de forma que les regions diferents de l'ou adquireixen diferents propietats. Això pot passar per la diferent localització dels factors de transcripció i traducció en l'ou o pel control diferencial de les activitats d'aquests factors.
Després continua una altra etapa en la qual es determinen les identitats de les parts de l'embrió: es defineixen regions de les quals deriven parts concretes del cos.
Els gens que regulen el procés codifiquen reguladors de la transcripció i actuen uns sobre els altres de forma jeràrquica i a més també actuen sobre altres gens que són els que veritablement s'encarreguen de l'establiment d'aquest patró (actuen en cascada).
També s'han de tindre en compte les interaccions cèl·lula-cèl·lula puix que defineixen les fronteres entre els grups cel·lulars.
Hi ha 3 grups de gens en funció dels seus efectes sobre l'estructura d'un segment:
La següent etapa del desenvolupament depèn dels gens que s'expressen en la mosca mare. Aquests gens s'expressen abans de la fertilització. Poden dividir-se en:
Existeixen quatre grups de gens que intervenen en el desenvolupament de les diferents parts de l'embrió. Cada grup s'organitza en una via diferent que presenta un ordre concret d'actuació. Cada via s'inicia amb fets que tenen lloc fora de l'ou, el que dóna com a resultat la localització d'un senyal dins d'aquest. Aquests senyals (són proteïnes que reben el nom de morfògens) es distribueixen de forma asimètrica per complir funcions diferents.
De l'eix antero-posterior s'encarreguen 3 sistemes i del dorso-ventral se n'encarrega un:
Tots els components dels quatre sistemes són materns pel que els sistemes que estableixen el patró inicial depenen de successos anteriors a la fertilització.
Existeix una complexa interrelació entre oòcit i cèl·lules fol·liculars (gens de l'oòcit són necessaris per al desenvolupament de cèl·lules fol·liculars i senyals d'aquestes, transmeses a l'oòcit, provoquen el desenvolupament d'estructures ventrals).
Una altra via s'encarrega del desenvolupament dorsal durant el creixement de l'ou.
Els sistemes funcionen per l'activació d'una interacció ligando-receptor que desencadena una via de transducció.
El procés depèn, en el seu inici, del gen Gurken (que actua també en diferenciació antero-posterior). El mRNA de Gurken se situa en la cara posterior de l'oòcit fent que les cèl·lules fol·liculars adjacents es diferenciïn en cèl·lules posteriors. Aquestes cèl·lules tornen un senyal que desencadena la producció d'una xarxa de microtúbuls que és necessària per a la polaritat.
La polaritat dorsoventral s'estableix quan gurken arriba a la cara dorsal de l'oòcit (depèn de l'expressió d'uns quants gens més).
El producte de Gurken actua com ligando interaccionant amb el receptor (producte del gen Torpedo) d'una cèl·lula fol·licular.
L'activació d'aquest receptor desencadena una via de senyalització en la qual l'efecte final és l'impediment que es desenvolupi la cara ventral en la dorsal (es produeix un canvi en les propietats de les cèl·lules fol·liculars d'aquesta cara).
El desenvolupament d'estructures ventrals requereix gens materns que estableixen l'eix dorso-ventral. El sistema dorsal és necessari per al desenvolupament d'estructures ventrals (com mesoderma i ectoderma). Mutacions en ell, impedeixen el desenvolupament ventral.
La via del desenvolupament ventral, també s'inicia en les cèl·lules fol·liculars i acaba en l'oòcit. En les cèl·lules fol·liculars es produeixen una sèrie de senyals que acaben generant un ligando per al receptor (producte del gen Toll = primer component de la via, que actua dins de l'oòcit).
Toll és el gen crucial en el transport del senyal a l'interior de l'oòcit.
La resta de components del grup dorsal codifiquen productes que, o regulen o són necessaris per l'acció del Toll. Toll és una proteïna transmembranal (homòloga al receptor de la interleuquina 1).
La unió del seu ligando al receptor Toll, activa la via que determina el desenvolupament ventral. La distribució del producte d'aquest gen és molt variable, però només indueix la formació d'estructures ventrals en llocs adequats (sembla que només s'expressa producte actiu en certes regions).
Rere la unió del ligando, el receptor Toll s'activa en la cara ventral de l'embrió. Aquesta activació desencadena en una sèrie de processos en els quals intervenen els productes d'altres gens i que acaba en la fosforilació del producte del gen cactus que és el regulador final del factor de transcripció del gen Dorsal.
En el citoplasma hi ha un complex cactus-dorsal inactiu però que al fosforilar-se, cactus allibera a la proteïna dorsal, que entra en el nucli.
L'activació del toll porta a l'activació del dorsal.
S'estableix un gradient de proteïna dorsal en el nucli que va del costat dorsal al ventral en l'embrió. En la cara ventral, la proteïna dorsal s'allibera cap al nucli però en la dorsal, es queda en el citoplasma.
La proteïna dorsal activa als gens Twist i Snail (necessaris per al desenvolupament d'estructures ventrals) i inhibeix als gens Decapentaplegic i Zerknullt (necessaris per al desenvolupament d'estructures dorsals). La interacció inicial entre gurken i torpedo porta a la repressió de l'activitat de spatzle a la cara dorsal de l'embrió (ligando de toll).
La proteïna dorsal, situada en el nucli, inhibeix l'expressió de dpp. D'aquesta manera, les estructures ventrals es formen segons un gradient nuclear de la proteïna dorsal i les estructures dorsals segons un gradient de la proteïna dpp.
El genoma de D. melanogaster (seqüenciat el 2000, i curat en el FlyBase database[5]) conté quatre parells de cromosomes: un parell X/Y, i tres autosomes assenyalats com a 2, 3, 4. El quart cromosoma és tan petit que a vegades s'ignora, excepte l'important gen sense ulls. El genoma seqüenciat de D. melanogaster de 139,5 milions de parells de bases[6] conté aproximadament 15.016 gens. Més del 60% del seu genoma és funcional en codificar DNA no codificador de proteïnes[7] involucrats en el control de l'expressió gènica. La determinació de sexe en Drosophila es produeix per la relació de cromosomes X a autosomes, no és degut a la presència d'un cromosoma Y com passa en la determinació de sexe en humans. Encara que el cromosoma Y és totalment heterocromatina, conté almenys 16 gens, molts dels quals compleixen funcions relatives al sexe masculí.[8]
Prop del 75% de gens humans vinculats amb malalties, tenen el seu homòleg en el genoma de la mosca del vinagre,[9] i el 50% de les seqüències de proteïnas de la mosca té el seu homòleg en mamífers. Existeix una Base de Dades en línia, anomenada Homophila està disponible per estudis de malalties genètiques humanes homòlogues en mosques i viceversa.[10] La Drosophila segueix sent utilitzada extensament com a model genètic per diverses malalties humanes incloent a trastorns neurodegeneratius Parkinson, Huntington, atàxia espinocerebelosa i Alzheimer. Aquesta mosca també s'utilitza en estudis de mecanismes de l'Envelliment humà, sistema immunitari, diabetis, càncer i droga.
La mosca del vinagre o mosca de la fruita (Drosophila melanogaster, literalment "amant de la rosada de ventre negre") és una espècie dípter braquícer de la família dels drosofílids. S'usa sovint en experimentació genètica, atès que aproximadament el 61% dels gens de malalties humanes que es coneixen tenen una contrapartida identificable en el genoma de les mosques de la fruita, i el 50% de les seqüències proteiques de la mosca té anàlegs en els mamífers.
Per a propòsits d'investigació, fàcilment poden reemplaçar els humans. Proliferen ràpidament, de manera que moltes generacions poden ser estudiades en un curt temps, i ja es coneix el mapa complet del seu genoma. Va ser adoptada com a animal d'experimentació genètica per Thomas Hunt Morgan a principis del segle XX. Els seus 165 MB de genoma (1 MB = 1 milió de parells de bases) van ser publicats en març de l'any 2000 gràcies al consorci públic i la companyia Celera Genomics i contenen vora 13.600 gens.
Octomilka obecná (Drosophila melanogaster), čeleď octomilkovití, řád dvoukřídlí (Diptera). Druhové jméno pochází z řečtiny a znamená "černobřichá". Drosophily, tzv. "banánové" nebo "ovocné mušky", jsou využívány jako laboratorní zvířata nebo krmivo, ale především jako nejrozšířenější modelové organismy v biologii a v genetických studiích, fyziologii a evoluční biologii. Zástupci čeledi vrtulovití (Tephritidae) jsou také označování jako "ovocné mušky", což někdy může vést k nedorozuměním (tato čeleď patří k významným škůdcům na pěstovaném ovoci).
Pro laboratorní a chovatelské (krmivo) účely se z praktických důvodů často používá bezkřídlá mutace.
Původní (divoká) forma octomilky obecné má jasně červené oči a je dlouhá 2 až 3 mm. Vyskytuje se na kvasícím ovoci, marmeládách, ovocných šťávách apod. Beznohé larvy jsou dlouhé přibližně 7 mm a žijí v hnijící dužnině ovoce.
Octomilky, kterým chovatelé říkají "vinné mušky" jsou důležitým zdrojem potravy pro dravý hmyz, některé ryby, žáby a mláďata malých druhů ještěrů. Chovají se dvě formy octomilek – klasická, okřídlená, a se zakrnělými křídly (používá se častěji, je vhodnější jak pro chov tak manipulaci).
Optimální teplota pro chov je 25 °C, lze je chovat i při pokojové teplotě, ale jejich vývoj se prodlužuje. Naopak při vyšší teplotě, tj. 30 °C a více, začínají degenerovat.
Při optimální teplotě trvá jejich vývojový cyklus 8-10 dní. Z vajíček se larvy líhnou do 24 hodin, za 4 dny se 2x svlékají, potom se zakuklí a za 4 dny se líhnou dospělí jedinci.
Jejich jedinou nevýhodou je krátká životnost.
Tělní segmentace je ze všech živočichů asi nejrozvinutější u členovců a podrobně zkoumána byla u octomilky („mouchy“ rodu Drosophila). Octomilky jsou oblíbeným modelovým organismem genetiků, a proto není divu, že zde byl průběh segmentace popsán právě z molekulárního hlediska. Výraznou roli hraje v segmentaci těla hmyzu gen bicoid, který umožňuje již velmi záhy po oplození vajíčka rozlišit budoucí přední a zadní část embrya. Tento morfogen řídí spouštění dalších genů v jednotlivých tělních článcích, tyto geny se označují gap geny. Postupně se tím spouští čím dál jemnější kontrola nad jednotlivými oblastmi embrya.[2]
V tomto článku byl použit překlad textu z článku Drosophila melanogaster na anglické Wikipedii.
Octomilka obecná (Drosophila melanogaster), čeleď octomilkovití, řád dvoukřídlí (Diptera). Druhové jméno pochází z řečtiny a znamená "černobřichá". Drosophily, tzv. "banánové" nebo "ovocné mušky", jsou využívány jako laboratorní zvířata nebo krmivo, ale především jako nejrozšířenější modelové organismy v biologii a v genetických studiích, fyziologii a evoluční biologii. Zástupci čeledi vrtulovití (Tephritidae) jsou také označování jako "ovocné mušky", což někdy může vést k nedorozuměním (tato čeleď patří k významným škůdcům na pěstovaném ovoci).
Pro laboratorní a chovatelské (krmivo) účely se z praktických důvodů často používá bezkřídlá mutace.
Původní (divoká) forma octomilky obecné má jasně červené oči a je dlouhá 2 až 3 mm. Vyskytuje se na kvasícím ovoci, marmeládách, ovocných šťávách apod. Beznohé larvy jsou dlouhé přibližně 7 mm a žijí v hnijící dužnině ovoce.
Bananflue (Drosophila melanogaster) er en art i slægten bananfluer (eddikefluer).
Drosophila melanogaster er almindeligt anvendt i genetiske eksperimenter, fordi den har kort reproduktionstid, er genetisk simpel og har fået kortlagt sit DNA. Den er let og billig at formere.
Fluen er brun og har en størrelse på ca. 1-2,5 mm. Den har fået sit navn, da den bl.a. kan lægge sine æg på bananer
Bananfluens genom er på 139,5 millioner basepar fordelt på omkring 15.682 gener.
Bananfluens mange æg gør den svær at komme af med, men den kan fanges i en fælde med vin eller eddike som lokkemad. Man kan også bruge et brugt marmeladeglas, med frugt i, og huller i låget, sådan bananfluerne kan komme ned, men ikke op.
Bananflue (Drosophila melanogaster) er en art i slægten bananfluer (eddikefluer).
Drosophila melanogaster er almindeligt anvendt i genetiske eksperimenter, fordi den har kort reproduktionstid, er genetisk simpel og har fået kortlagt sit DNA. Den er let og billig at formere.
Fluen er brun og har en størrelse på ca. 1-2,5 mm. Den har fået sit navn, da den bl.a. kan lægge sine æg på bananer
Drosophila melanogaster (von altgriechisch δρόσος drosos „Tau“, φίλος philos „liebend“, μέλας melas „schwarz“ und γαστήρ gaster „Bauch“) ist eine von über 3000 Arten aus der Familie der Taufliegen (Drosophilidae). Sie ist einer der am besten untersuchten Organismen der Welt. Die recht ungebräuchlichen deutschen Bezeichnungen Schwarzbäuchige Fruchtfliege oder Schwarzbäuchige Taufliege für dieses Tier sind relativ neu und tauchen in der deutschsprachigen Literatur erst nach 1960 auf. Als „Fruchtfliegen“ wurden im fachlichen deutschen Sprachgebrauch ursprünglich nicht die Vertreter der Familie der Drosophilidae, sondern nur der Tephritidae bezeichnet.[1]
Drosophila melanogaster (synonym unter anderem mit Drosophila ampelophila Loew[2]) wurde erstmals 1830 von Johann Wilhelm Meigen beschrieben. Als geeigneten Versuchsorganismus nutzte sie 1901 zuerst der Zoologe und Vererbungsforscher William Ernest Castle. Er untersuchte an D.-melanogaster-Stämmen die Wirkung von Inzucht über zahlreiche Generationen und die nach Kreuzung von Inzuchtlinien auftretenden Effekte. 1910 begann Thomas Hunt Morgan ebenfalls, die Fliegen im Labor zu züchten und systematisch zu untersuchen. Seitdem haben viele andere Genetiker an diesem Modellorganismus wesentliche Erkenntnisse zur Anordnung der Gene in den Chromosomen des Genoms dieser Fliege gewonnen.
Drosophila melanogaster war ursprünglich eine tropische und subtropische Art. Sie hat sich jedoch gemeinsam mit dem Menschen über die ganze Welt verbreitet und überwintert in Häusern. Die Weibchen sind etwa 2,5 Millimeter lang, die Männchen sind etwas kleiner. Letztere sind leicht an ihrem stärker abgerundeten, durch Melanine fast einheitlich dunkel gefärbten Hinterleib von den Weibchen unterscheidbar, die in der Aufsicht einen spitzeren Hinterleib besitzen und die schwarzen Melanine mehr in Form eines Querstreifenmusters in die Körperdecke (Cuticula) ihres Hinterendes eingelagert haben. Die Augen der kleinen Fliegen sind durch Einlagerung von braunen Ommochromen und roten Pterinen in typischer Weise rot gefärbt.
Die Gattung Drosophila im klassischen Sinn umfasst 1450 valide Arten und ist das artenreichste Taxon der Drosophilidae. Neuere Arbeiten, die auf Phylogenomik (Untersuchung von Verwandtschaftsverhältnissen durch den Vergleich von homologen DNA-Sequenzen), aber auch auf Morphologie, zum Beispiel der männlichen Genitalarmatur, aufbauen, haben gezeigt, dass die konventionelle Gattung Drosophila paraphyletisch ist.[3][4] Das bedeutet: Einige Arten, die bisher in mindestens acht, wahrscheinlich aber eher fünfzehn anderen Gattungen geführt werden, sind näher mit bestimmten Artengruppen innerhalb von Drosophila verwandt, als diese es untereinander sind. Die Untergattung Sophophora Sturtevant, 1939 steht dabei relativ basal, das heißt spaltet sich früh von dem verbleibenden Artenkomplex ab (sie ist allerdings selbst ebenfalls paraphyletisch.)[5]
Die normale Vorgehensweise in einem solchen Fall wäre, die Großgattung Drosophila aufzuspalten und die (Altwelt-Klade der) Untergattung Sophophora in den Gattungsrang zu erheben, was zu der Umkombination Sophophora melanogaster für unsere Art führen würde. Dies wäre für Fliegentaxonomen mehr oder weniger Alltag. Es hätte aber gravierende Auswirkungen auf die in diesem Fall extrem bedeutsame angewandte Forschung an der Art, wo sogar oft nur abgekürzt von Drosophila geredet wird. Die eingeschachtelten Gattungen einfach in Drosophila als Supergattung aufgehen zu lassen, hätte ebenfalls unerwünschte Konsequenzen: So hießen dann vier verschiedene Arten Drosophila serrata und vier andere Drosophila carinata.[6] Kim van der Linde versuchte, Drosophila melanogaster nachträglich zur Typusart der Gattung erklären zu lassen,[7] was von der ICZN abgelehnt wurde.[8] Andere schlugen vor, von den Regeln der Kladistik abzuweichen und paraphyletische Gattungen wieder zuzulassen.[9] Die formale Revision der Gattung Drosophila ist bisher, und zwar ausschließlich aus diesem Grund, unterblieben, so dass Drosophila melanogaster weiterhin der taxonomisch valide Name der Art ist, weil bisher kein Taxonom bereit war, die Konsequenzen der Umbenennung zu verantworten.
Die Weibchen legen insgesamt etwa 400 weißlich-gelbliche, von einem Chorion und einer Vitellinmembran umhüllte Eier, die etwa einen halben Millimeter groß sind, auf Obst und verfaulendem, gärendem organischen Material ab. Ihre Vorliebe für Zitrusduft schützt Taufliegen vor Parasiten.[10] Die Dauer der Entwicklungszeit hängt von der Umgebungstemperatur ab. Bei einer Temperatur von 25 °C schlüpft aus jedem Ei nach etwa 22 Stunden als Larve eine Made, die sich sofort auf die Suche nach Futter macht. Die Nahrung besteht in erster Linie aus den Mikroorganismen, die das Obst zersetzen, wie zum Beispiel Hefen und Bakterien, und erst in zweiter Linie aus dem zuckerhaltigen Obst selbst. Nach etwa 24 Stunden häutet sich die Larve, die ständig wächst, zum ersten Mal und erreicht das zweite Larvenstadium. Nach dem Durchlaufen von drei Larvenstadien und einem viertägigen Puppenstadium schlüpft bei 25 °C nach insgesamt neun Tagen Entwicklungszeit das flugfähige Insekt, das dann innerhalb von etwa 12 Stunden geschlechtsreif ist.[11]
Nach der Befruchtung des D. melanogaster-Eies und der Verschmelzung der Zellkerne erfolgen mehrere schnell aufeinander folgende synchrone Kernteilungen (Mitosen), bei denen eine Abgrenzung durch Zellmembranen unterbleibt. So entsteht ein Embryo, der aus einer Zelle mit vielen Zellkernen besteht, die nicht durch Membranen abgegrenzt werden. Dieser Zustand wird als synzytiales Blastoderm beziehungsweise als polyenergid bezeichnet. Bereits nach der siebten Kernteilung wandern die meisten Kerne an die Peripherie des Embryos, also unter die äußere Zellmembran. Zwischen der achten und neunten Kernteilung werden acht bis zehn Zellkerne in das posteriore Polplasma eingeschlossen und beginnen sich daraufhin unabhängig von den anderen Kernen zu teilen. Aus diesen so genannten Polzellen entwickeln sich die Keimzellen.
Aus dem synzytialen Blastoderm entsteht etwa 2,5 Stunden nach der Eiablage das „zelluläre Blastoderm“, und zwar durch Einstülpung und Wachstum der äußeren Zellmembran in die Regionen zwischen den einzelnen Kernen. Auf diese Weise wird das erste einschichtige Epithel der entstehenden Fliege gebildet und den Zellkernen damit der Zugang zu asymmetrisch verteilten, morphogenen Genprodukten verwehrt (siehe zum Beispiel bicoid). Entsprechend ist das Entwicklungspotential der Zellen zu diesem Zeitpunkt in Abhängigkeit von ihrer Position bereits weitgehend festgelegt.
Eine ventrale Einfurchung entlang der Längsachse (Ventralfurche) leitet die Gastrulation ein, durch die das Blastodermepithel in drei Keimblätter aufgeteilt wird: Durch die ventrale Einfurchung, die an der „Bauchseite“ längs des Embryos erfolgt, entsteht die Mesodermanlage. Eine anterior der Ventralfurche stattfindende Einstülpung (Invagination), die das Stomodeum bildet, und eine am posterioren Pol des Embryos stattfindende Invagination, die das Proktodeum bildet, grenzen das spätere Entoderm ab. Die an der Außenseite des Embryos verbleibenden Zellen und die Endbereiche der stomodealen und proktodealen Invaginationen bilden das Ektoderm. Mit der Verlängerung des Keimstreifs wandern die Polzellen von posterior in das Innere des Embryos. Die Organogenese setzt ein und zum ersten Mal wird eine embryonale Metamerie erkennbar. Etwa 7,5 Stunden nach der Befruchtung beginnt die Keimstreifverkürzung, die mit dem Dorsalschluss (dorsal closure) endet. Nach weiteren Differenzierungsschritten schlüpft etwa 21 Stunden nach der Befruchtung die vollständig entwickelte Larve.
Die fußlosen, segmentierten Maden besitzen an ihrem etwas stärker zugespitzten Vorderende einen dunklen Chitin-Stift, der ausgestreckt und eingezogen werden kann und die recht kümmerlichen Mundwerkzeuge enthält. Die Larven kriechen im Nahrungsbrei oder in der Umgebung der Nahrungsquelle umher, fressen und wachsen innerhalb weniger Tage von der Größe des Eies (0,5 mm) bis zur Größe der Fliege (2,5 mm) heran. Sie häuten sich in dieser Zeit zweimal. Es werden dementsprechend drei Larvenstadien unterschieden.
Im letzten Larvenstadium stellt das Insekt bald das Umherkriechen ein und verpuppt sich. Die Puppe färbt sich zunächst nach und nach braun, ähnelt bei D. melanogaster aber nicht einer typischen Insektenpuppe, sondern sieht eher wie eine verschrumpelte und vertrocknete Made aus. Im Inneren der Madenhaut entwickelt sich nämlich eine Tönnchenpuppe, deren Hülle aus verhärteter Larvenhaut besteht. Nach einigen Tagen platzt ein Deckel am Ende des Tönnchens auf, und eine fertig entwickelte Taufliege kriecht heraus, die ihre Körperdecke nachträglich noch etwas verfärbt und aushärtet und ihre Flügel ausrichtet.
Das Geschlecht der Taufliege ist – wie bei den meisten Tieren – genetisch bedingt. D. melanogaster hat nur vier verschiedene Chromosomen, sie kommen in den Zellen paarweise vor. Dieser zweifache Chromosomensatz enthält ein Paar Geschlechtschromosomen, die auch als erstes Chromosom oder X- beziehungsweise Y-Chromosom bezeichnet werden, und drei Paar Autosomen, die als zweites, drittes und viertes Chromosom bezeichnet werden. Ebenso wie der Mensch besitzt D. melanogaster zwei Geschlechtschromosomen: Weibchen haben zwei X-Chromosomen, sind homogametisch; Männchen haben ein X- und ein Y-Chromosom, sind heterogametisch. Anders als beim Menschen jedoch trägt das Y-Chromosom keine geschlechtsbestimmende Komponente, vielmehr ist das Verhältnis der X-Chromosomen zu den Autosomen geschlechtsbestimmend.[12]
Liegt das Verhältnis von X-Chromosom zu Autosomensatz bei größer oder gleich 1 (z. B. zwei X im diploiden Satz), so entsteht ein Weibchen; ist es kleiner oder gleich 0,5 (z. B. ein X im diploiden Satz), entsteht ein Männchen. Mutanten mit dazwischenliegenden Verhältnissen, etwa bei XX und triploidem Autosomensatz (Verhältnis: 0,67) bilden Intersexe aus mit mosaikartig verteilten männlichen und weiblichen Merkmalen (sogenanntes „Salz-und-Pfeffer-Muster“). Das Geschlecht wird demnach von jeder Zelle selbst festgelegt; es kann bei nicht eindeutigem Effekt (zwischen 0,5 und 1) verschieden sein.
Die Kompensation der unterschiedlichen Gendosen von nicht geschlechtsbestimmenden Genen des X-Chromosoms gelingt durch eine beim Männchen stark erhöhte Transkriptionsrate. Ermöglicht wird dies durch Acetylierungen von Lysinresten des Histons H4, womit die elektrostatische Wechselwirkung zwischen dem Histonkomplex und dem Zucker-Phosphat-Rückgrat der DNA abnimmt; die somit weniger stark an die Nukleosomen gebundene DNA ist nun leichter ablesbar. Derart kann mit Hyperaktivierung des singulären X-Chromosoms des Männchens dessen geringere Gendosis kompensiert werden.
Die Entscheidung, welche geschlechtsspezifischen Gene wie transkribiert werden, wird über das Gen sex lethal (Sxl) gesteuert. Bei Weibchen ist Sxl aktiv, bei Männchen inaktiv. Das Genprodukt Sxl ist ein RNA-spleißendes Enzym, das die sogenannte Transformer-mRNA spleißt. Das entstehende Protein „Transformer“ (tra) ist ebenfalls ein Spleißfaktor, welcher die mRNA des Gens double sex (dsx) spleißt. Das produzierte dsx bewirkt dann die eigentliche Geschlechtsfestlegung auf molekularer Ebene, und zwar ebenfalls als Transkriptionsfaktor. Das Protein dsx gibt es in einer männlichen und weiblichen Variante.
Weibchen: sxl aktiv, tra aktiv, dsxF (Female) entsteht. Die Realisatorgene des männlichen Geschlechts werden reprimiert. Männchen: sxl inaktiv, tra inaktiv, dsxM (Male) entsteht. Die Realisatorgene des weiblichen Geschlechts werden reprimiert.
Der Zusammenhang zwischen Aktivität von „sex lethal“ und der X-Chromosomen-Dosis erklärt sich nun folgendermaßen: Auf dem X-Chromosom werden 3 Gene für Transkriptionsfaktoren im syncytialen Blastoderm aktiviert, die auch „Numeratorgene“ genannt werden. Diese Faktoren (Beispiel: sisterless) binden an den sogenannten early promoter, eine regulatorische Region vor dem Sxl-Gen, und aktivieren es. Auf den Autosomen sind hingegen Gene zu finden, die man „Denominatorgene“ nennt. Sie codieren Faktoren (Beispiel: deadpan), die dem entgegenwirken.
Das Verhältnis X-Chromosomen zu Autosomen ist somit als ein Verhältnis der Numeratorgene zu Denominatorgenen aufzufassen. Liegt ein weiblicher Chromosomensatz vor (XX), überwiegen die Numeratorgene und aktivieren die Sxl-Transkription. Bei einem männlichen Satz (XY) sind dagegen die Denominatoren in Überzahl, die Transkription von Sxl wird reprimiert. In diesem Fall ist Sxl im Entwicklungsverlauf somit inaktiv.
Das Sxl-Gen besitzt zusätzlich einen late promoter. Dieser ist in der späteren Entwicklung konstitutiv in beiden Geschlechtern aktiviert. Durch eine Autoregulation von Sxl bleibt jedoch das Level an Sxl-Protein in weiblichen Zellen hoch, in männlichen niedrig. In weiblichen Zellen nämlich bindet frühes Sxl-Protein an Poly(U)-Sequenzen in Introns später Sxl-prä-mRNA. Jene Introns flankieren das Exon3, das ein Stop-Codon enthält. Wenn Sxl-Protein an diese Introns bindet, wird das Exon3 nicht als solches erkannt und herausgespleißt. Die Translation der so erzeugten Sxl-mRNA ergibt weiteres effektives Sxl-Protein. In männlichen Zellen ist die Konzentration an frühem Sxl-Protein nahezu null, sodass das Stop-Codon der späten Sxl-prä-mRNA wirksam wird. Die Translation der aus jener erzeugten mRNA ist daher unvollständig und ergibt keine effektive Isoform von Sxl.
Bei D. melanogaster ist die Festlegung des Geschlechts somit "zellautonom", d. h. durch interne Steuerungsmechanismen der einzelnen Zelle erklärbar. Jede Zelle „zählt“ gewissermaßen ihr X/Y-Verhältnis ab und entwickelt sich dementsprechend.
Das zentrale Nervensystem der D. melanogaster Larve ist aus den zwei Gehirnloben und dem ventralen Ganglion aufgebaut, welches das Bauchmark darstellt.[13] Die zwei Gehirnloben sind ventral miteinander verbunden. Die Fusionsstelle der beiden wird durch den Oesophagus durchstoßen, welcher dorsal über dem Ventralganglion verläuft. Das Fenster, durch das der Oesophagus läuft, wird Foramen genannt.[13]
Von jedem Gehirnlobus gehen der Antennennerv und der Bolwig-Nerv aus. Ein Querschnitt der Gehirnloben zeigt, dass sich die Gehirnloben aus einem Cortex aus neuronalen Somata sowie einem zentralen Neuropil zusammensetzen. Das Neuropil zeichnet sich durch eine große Dichte von Dendriten und synaptischen Endigungen aus, welche untereinander über synaptische Kontakte kommunizieren.
Das Ventralganglion ist ebenfalls in Cortex und Neuropil gegliedert. Jeder Gehirnlobus besitzt einen Pilzkörper, ein optisches Neuropil und einen larvalen Antennallobus. Ein Zentralkomplex ist bis jetzt in der Larve nicht gefunden worden. Theoretisch sollte er aber vorhanden sein, da er für die visuelle Koordination von Bewegung zuständig ist. Eventuell übernehmen Neurone, welche nicht auf typische Art einen Zentralkörper aufbauen, diese Aufgaben. Im larvalen Stadium nehmen Gehirn und Ventralganglion an Größe zu. Dies beruht darauf, dass Neuroblasten bereits während der Larvalphase beginnen, sich zu teilen, und in weiten Teilen des Gehirns neuronale Vorläuferzellen der späteren Neurone generieren. Der im ZNS häufigste exzitatorische Neurotransmitter ist, im Gegensatz zu den Wirbeltieren, Acetylcholin. Glutamat und andere kommen ebenfalls vor. Der hauptsächliche inhibitorische Transmitter ist γ-amino-Buttersäure (GABA).[13]
Im larvalen Antennallobus enden die Projektionen der olfaktorischen Rezeptorneuronen. Ausgangsneurone (sogenannte Projektionsneurone) ziehen vom larvalen Antennallobus über den Antennozerebraltrakt zum Pilzkörper. Hierbei projizieren 21 Projektionsneurone auf 28 Calyx-Glomeruli des Pilzkörpers.[14]
Der Pilzkörper ist im larvalen Stadium um einiges einfacher aufgebaut als bei der erwachsenen Fliege. Nach dem Eischlupf besitzt die L1-Larve ca. 250 Kenyonzellen, deren Anzahl sich innerhalb der 3 Larvenstadien auf ca. 2000 Zellen erhöht. Der Pilzkörper integriert verschiedene Sinnesinformationen und hat eine wichtige Funktion beim olfaktorischen Lernen. Der Pilzkörper besteht aus einem Calyx („Kelch“), an der sich ventral ein Stiel (Pedunculus) anschließt. Der Pedunculus teilt sich in verschiedene Loben. Der Pilzkörper erhält auch olfaktorische Eingänge aus dem Antennallobus.[15]
Das Ventralganglion befindet sich im dritten Thoraxsegment und reicht bis hin zum ersten Abdominalsegment der Larve.[13] Das Ventralganglion besteht aus drei suboesophagialen Neuromeren, drei thorakalen Neuromeren (Pro-, Meso- und Metathorakalneuromeren) und acht abdominalen Neuromeren, die miteinander zu einem Ganglion fusioniert sind. Der strukturelle Aufbau des Nervensystems in der frühen Embryonalentwicklung von D. melanogaster ähnelt dem einer Strickleiter. In der späten Embryonalentwicklung kommt es zu einer Fusion der abdominalen und thorakalen Neuromeren. Einzelne Ganglien sind nach der Fusion nicht mehr zu erkennen. Aus den acht abdominalen Neuromeren geht je ein paariger Segmentalnerv ab, welcher die entsprechenden Segmente innerviert. Der Segmentalnerv leitet sensorische Informationen auf den afferenten Bahnen von der Peripherie ins zentrale Nervensystem. Zudem leitet der Segmentalnerv motorische Informationen auf efferenten Bahnen vom zentralen Nervensystem in die Peripherie.[16]
Das adulte Zentralnervensystem von Drosophila melanogaster setzt sich aus fusioniertem Oberschlundganglion und Unterschlundganglion (Gehirn) zusammen, sowie thorakalen und abdominalen Ganglien, die zu einem Ventralganglion fusioniert sind.
Das symmetrische Oberschlundganglion enthält ca. 100.000 Neurone, das Volumen beträgt ca. 0,2 mm³ und das Gewicht ca. 0,25 mg. Es besteht aus drei verschmolzenen Teilen, die entwicklungsgeschichtlich von den drei ursprünglichen Kopfsegmenten abstammen: Einem großen Protocerebrum, einem kleineren Deutocerebrum und einem sehr kleinen Tritocerebrum. Am Protocerebrum befinden sich die beiden optischen Loben, Gehirnlappen, die für die visuelle Verarbeitung zuständig sind. Das Deutocerebrum erhält über olfaktorische Rezeptorneurone olfaktorische Informationen, die in die Antennalloben gelangen. An den Antennen befinden sich ebenfalls Mechanorezeptoren zur Detektion mechanischer Reize. Diese Information wird in das antennomechanische Zentrum im Deutocerebrum geleitet.[13]
Zentralkomplex, optische Loben, Antennalloben und Pilzkörper stellen wichtige funktionelle Einheiten des adulten Gehirns dar. Der Zentralkomplex besteht aus vier deutlich abgrenzbaren Neuropilregionen. Hiervon liegt die Protozerebralbrücke am weitesten posterior ("hinten"), anterior davor liegt der Zentralkörper mit einer größeren oberen Einheit (Fächerkörper) und einer kleineren unteren Einheit (Ellipsoidkörper), sowie die beiden posterioren Noduli. Der Zentralkomplex spielt eine Rolle bei der motorischen Kontrolle und der visuellen Orientierung. So haben beispielsweise Fliegen mit Mutationen im Zentralkomplex ein vermindertes visuelles Orientierungsvermögen.[17]
Die optischen Loben sind für die Verarbeitung optischer Reize zuständig. Sie enthalten vier Verschaltungsebenen: Lamina, Medulla, Lobula und Lobularplatte. Die olfaktorischen Eingänge werden in den beiden Antennalloben verarbeitet, die aus sog. Glomeruli bestehen. Diese kugelartigen Strukturen stellen verdichtetes Neuropil dar. Über Geruchsrezeptoren an den Antennen werden olfaktorische Reize detektiert und in elektrische Signale umgewandelt. Die Erregung wird über Rezeptorneurone in die Glomeruli und von dort über Projektionsneurone in Pilzkörper und laterales Horn geleitet, wo die Information verarbeitet wird. Zur Modulation dienen lokale Neurone, die die Glomeruli innervieren.[18]
Die Pilzkörper sind zusammengesetzt aus Calyx und Pedunculus und sind der Sitz von höheren integrativen Leistungen, wie olfaktorisches Lernen und Gedächtnis. Dies konnten verschiedene Arbeitsgruppen z. B.durch transgene Techniken in rutabaga-Mutanten zeigen.[13][19]
Das Unterschlundganglion weist eine klare segmentale Gliederung auf. Es liegt unterhalb des Oesophagus und besteht aus den drei fusionierten Neuromeren des mandibularen, maxillaren und labialen Segments.[13] Afferente Bahnen aus der Peripherie, die sensorische Informationen, z. B. von den Mundwerkzeugen, leiten, enden im Unterschlundganglion. Efferente Bahnen, die die Motorik in der Peripherie innervieren, entspringen dem Unterschlundganglion. Über die Schlundkonnektive ist das Unterschlundganglion mit dem Bauchmark verbunden.[13]
In D. melanogaster, wie auch in anderen Insekten, ist das viscerale Nervensystem, welches den Verdauungstrakt und die Geschlechtsteile innerviert, ein Bestandteil des peripheren Nervensystems und untergliedert sich wiederum in das ventrale viscerale, das caudale viscerale und das stomatogastrische System.
Das stomatogastrische Nervensystem innerviert die vordere Schlundmuskulatur und den Vorderdarm. Obwohl Frontalnerv und Nervus recurrens vorhanden sind, fehlt dem stomatogastrischen Nervensystem ein typisches Frontalganglion, das lediglich als Nervenkreuzung ausgebildet ist. Das stomatogastrische Nervensystem beinhaltet aber ein Proventrikularganglion und ein Hypocerebralganglion, die über den Proventrikularnerv miteinander verbunden sind.[13][20] Das ventrale caudale System bezeichnet die dem unpaaren Mediannerv zugehörigen Äste und steht in Verbindung mit den thorakalen und abdominalen Neuromeren des Bauchmarks. Das ventrale caudale System innerviert beispielsweise die Tracheen.[13]
Das adulte Nervensystem entwickelt sich nicht erst während der Metamorphose komplett neu, sondern formt sich überwiegend aus einem Gerüst larvaler sensorischer Neurone, Inter- und Motoneurone. Die meisten sensorischen Neurone aus dem Larvenstadium degenerieren während der Metamorphose und werden durch adulte Neurone ersetzt, die sich aus den Imaginalscheiben entwickeln. Dadurch entsteht ein Teil des peripheren Nervensystems. Die adulten Interneurone bestehen zu einem kleinen Teil aus umgebauten larvalen Interneuronen, der Hauptanteil wird allerdings erst während der Metamorphose aus Neuroblasten gebildet. Diese Neurone werden vor allem für das optische System, die Antennen, den Pilzkörper und das thorakale Nervensystem gebraucht, um die Informationen der adultspezifischen Strukturen (Komplexaugen, Beine, Flügel) zu verarbeiten. Die Motoneurone bleiben überwiegend erhalten und werden während der Metamorphose in adultspezifische Neurone umgewandelt. Diese Motoneurone werden hauptsächlich für die neue Bein- und Flugmuskulatur, als auch für die Körperwandmuskulatur benötigt. Die postembryonale Neubildung von Neuronen, das Absterben larvaltypischer Neurone, sowie die Modifizierung bestehender larvaler Neurone werden von Genkaskaden reguliert, die vor allem von dem Steroidhormon Ecdyson ausgelöst werden.[21][22]
12-14 Stunden nach der Verpuppung degenerieren larvale Elemente vor allem in der Abdominalregion, die verbleibenden Neurone verkürzen ihre Axone und Dendriten. Außerdem entsteht eine Einschnürung zwischen dem suboesophagealen und dem thorakalen Bereich des ZNS, das damit sein larvales Aussehen verliert.
24 Stunden nach der Verpuppung beginnt die vollständige Differenzierung adulter Neurone, indem sich ihre Verzweigungen in größere Bereiche ausbreiten. Dies trägt neben der Bildung neuer Neurone zu einer Vergrößerung des Gehirns bei. Im larvalen Stadium besteht das olfaktorische System beispielsweise nur aus 21 sensorischen Neuronen, in den adulten Antennen hingegen aus ca. 1200 afferenten Fasern.[21][23]
Nach Abschluss der Metamorphose kommt es zum Absterben von Motoneuronen und peptidergen Neuronen, die nur zum Schlüpfen gebraucht werden und im adulten Tier keine Funktion haben.[21]
Das adulte Gehirn der D. melanogaster weist geschlechtsspezifische Unterschiede in der Morphologie auf. Männchen besitzen bestimmte Regionen im Gehirn, sogenannte MERs (male enlarged regions), die im Vergleich zu Weibchen deutlich vergrößert sind. Im Durchschnitt sind diese etwa 41,6 % größer. Auch Weibchen besitzen vergrößerte Strukturen, hier FERs (female enlarged regions), welche jedoch durchschnittlich nur ca. 17,9 % größer sind als die männlichen Gegenstücke. Durch Volumenberechnung der MERs ist es möglich, lediglich anhand des Gehirns eine Aussage über das Geschlecht der Fliege zu machen. Der größte Teil der MERs liegt im olfaktorischen Bereich des Gehirns. Dies erklärt das unterschiedliche Verhalten von Männchen und Weibchen auf Gerüche. Setzt man beispielsweise beide Geschlechter dem männlichen Pheromon cVA aus, so wirkt dieses auf Männchen abstoßend, auf Weibchen jedoch aphrodisierend.[24]
Ähnlich wie für die Geschlechtsdetermination sind die beiden Gene sex lethal (sxl) und transformer (tra) für die geschlechtsspezifischen, morphologischen Unterschiede des Gehirns zuständig. Sind beide aktiv, stellt das Gen doublesex (dsx) die weibliche Variante des Proteins DsxF her, welches die für Weibchen charakteristischen Regionen vergrößert (FER). Sind die Gene sxl und tra jedoch inaktiv, so stellt das Gen dsx die männliche Variante DsxM her, das für die differenzielle Ausbildung der MERs zuständig ist. Um aus einem einzelnen Gen zwei verschiedene Proteine zu synthetisieren, ist alternatives Spleißen notwendig. In diesem Fall geschieht dies durch die Regulatorgene sxl und tra.
Zudem ist das Gen fruitless (fru) an dem sexuellen Dimorphismus des zentralen Nervensystems beteiligt. Im weiblichen Wildtyp stellt es das nonfunktionale Protein FruF her. Im Männchen entsteht dementsprechend das Protein FruM. Dieses ist entscheidend für das normale Balzverhalten der Männchen. In Versuchen, bei denen man weibliche Mutanten herstellte, welche das Protein FruM synthetisieren konnten, konnte festgestellt werden, dass die Regionen, die normalerweise bei Männchen vergrößert sind, auch in diesen Weibchen vorhanden waren, wenn auch nicht im gleichen Ausmaße.[25][26]
Während der Embryonalentwicklung kommt es im vorderen dorsalen Blastoderm zu einer plattenartigen Verdickung, welche invaginiert, sich in die Tiefe absenkt und sich zu sogenannten Plakoden ausbildet, die paarig vorliegen und sich lateral an die Oberfläche des sich entwickelnden Hirns als optische Anlagen anheften. Während der Larvenstadien nehmen die optischen Anlagen an Größe zu und transformieren sich, um in der Puppe zu den adulten optischen Loben auszudifferenzieren. Die optischen Anlagen spalten sich in die inneren und äußeren optischen Loben sowie in die adulte Retina. Aus den Anlagen der äußeren optischen Loben entwickeln sich zwei äußere optische Neuropile, die Lamina und Medulla. Die Anlagen für die inneren optischen Loben entwickeln sich in die Lobula und die Lobulaplatte. Bereits im zweiten Larvenstadium haben die sich entwickelnde Lamina und Medulla den Großteil des Volumens des Larvengehirns eingenommen. Während des dritten Larvenstadiums differenzieren sich die Lamina und Medulla weiter aus. Ebenfalls bilden sich die Verbindungen der inneren optischen Loben zum Zentralgehirn. An die Anlagen der optischen Loben angrenzend, befinden sich die Augen-Antennen-Imaginalscheiben, die sich aus undifferenzierten Stammzellen während der Embryogenese entwickeln. Während des dritten Larvenstadiums beginnt bereits eine Ausdifferenzierung, die in der Metamorphose bis zu vollständig differenzierten Komplexaugen weiterschreitet.[27][28] Das funktionelle Sehorgan der Larve ist das Bolwig-Organ. Es entsteht während der Embryonalentwicklung aus Vorläuferzellen, die sich von der optischen Invagination abspalten.[27] Das Bolwig-Organ besteht aus 12 Photorezeptorzellen mit den Rhodopsinen Rh5 und Rh6.[29] Rh5 absorbiert Licht im kurzwelligen blauen Bereich und gewährleistet die Lichtempfindlichkeit. Rh6 hingegen absorbiert langwelliges Licht und spielt zusätzlich eine wesentliche Rolle für die larvale innere Uhr.[30] Die Axone der Photorezeptoren bündeln sich und bilden den Bolwig-Nerv. Dieser projiziert durch die Augen-Antennen-Imaginalscheiben hindurch ins larvale Gehirn in das larvale optische Neuropil. Von dort aus folgen drei verschiedene Verschaltungen: auf serotonerge dendritisch verzweigte Neurone (SDA), auf dendritisch verzweigte ventrale laterale Neurone (LNvs) und auf visuelle Interneurone (CPLd).[31]
Aus den Augen-Antennen-Imaginalscheiben entwickeln sich die Ommatidien des Komplexauges. Die Photorezeptoraxone der Ommatidien ziehen über den Sehnerv (Nervus opticus) in das Gehirn. Bei der 24h alten Puppe ist das Auge ein relativ dickwandiger flacher Becher, bei dem die einzelnen Ommatidien klar sichtbar sind. Während der Augenbecher noch mehr abflacht, werden die Ommatidien dünner und kürzer. Später liegen die Ommatidien rund vor. Am Ende des zweiten Tages der Puppenentwicklung beginnt die Bildung der Cornealinsen und eine erste Pigmentierung erfolgt. Nach zweieinhalb Stunden schreitet die Pigmentierung in den Cornealinsen fort, das Auge erhält so eine bräunliche Farbe. Am Ende des Puppenstadiums nehmen die Ommatidien an Länge zu und differenzieren sich endgültig.[13]
Aus dem Bolwig-Organ entsteht das Hofbauer-Buchner-Äuglein, welches wie das Bolwig-Organ bei der circadianen Rhythmik eine wichtige Rolle spielt.[32] Am Ende der Metamorphose liegt das neuronale Superpositionsauge der Imago vor.
Das Komplexauge einer adulten D. melanogaster besteht aus ca. 800 Ommatidien, wovon jede eine funktionelle Einheit der Retina darstellt.[33] Die Ommatidien sind hexagonal zueinander gerichtet. Jedes Ommatidium besitzt einen dioptrischen Apparat, welcher sich aus einer Cornealinse und einem Kristallkegel zusammensetzt. Neben dem dioptrischen Apparat besitzt ein Ommatidium 8 Photorezeptoren, wovon jeder einen zur Mitte gerichteten Mikrovillisaum besitzt. Diese Mikrovillifortsätze nennt man Rhabdomere. Da D. melanogaster ein neuronales Superpositionsauge hat, sind die Rhabdomere anders als bei dem Appositionsauge und dem optischen Superpositionsauge nicht miteinander verschmolzen, sondern liegen isoliert voneinander vor. Bei Lichteinfall absorbiert zuerst die Cornealinse das Licht und leitet es an den Kristallkegel weiter. Von dort aus wird das Licht von den Farbpigmenten, den Rhodopsinen, in den Rhabdomeren detektiert. Die acht Rhabdomere sind unterschiedlich im Ommatidium angeordnet: Es befinden sich sechs Rhabdomere (R1-R6) kreisförmig um das 7. und 8. Rhabdomer, dabei liegt das 7. Rhabdomer über dem 8. Besonders an dem neuronalen Superpositionsauge ist, dass die Rhabdomere R1-R6 und R7+R8 eines Ommatidiums unterschiedliche Blickpunkte wahrnehmen, weil die Photorezeptoren in verschiedenen Winkeln zueinander stehen, wobei R7 und R8 den gleichen Blickpunkt anpeilen. Bei Lichteinfall durch das 7. Rhabdomer wird das nicht absorbierte Licht an das darunter liegende 8. Rhabdomer weitergeleitet. Obwohl jeder Photorezeptor eines Ommatidiums einen anderen Punkt fixiert, wird jeder Blickpunkt durch sechs Photorezeptoren erfasst. Dieser Punkt wird von sechs verschiedenen Photorezeptoren in sechs benachbarten Ommatidien detektiert. Insgesamt kann also ein Ommatidium sieben verschiedene Punkte wahrnehmen, d. h. einen durch die Photorezeptoren R7+R8 und die restlichen sechs durch die sechs Photorezeptoren R1-R6. Durch die retinotope Organisation der Reizverarbeitung der Photorezeptoren R1-R6 wird gewährleistet, dass die Informationen, die von den sechs Photorezeptoren aufgenommen werden, zusammen in einer funktionellen Einheit in der Lamina gesammelt werden. Diese funktionelle Einheit nennt man Cartridge.[34] Da eine Laminacartridge sechsmal die gleiche Information enthält, wird die Lichtsensitivität um den Faktor 6 verbessert. Das ermöglicht bei gleicher räumlicher Auflösung eine verbesserte Anpassung an schlechte Lichtverhältnisse.[35] Die Information der Photorezeptoren R7-8, welche essentiell für das Farbsehen ist, wird nicht in die Lamina, sondern direkt in die Medulla weitergeleitet.
Die optischen Loben, bestehend aus Lamina, Medulla und dem Lobulakomplex, stellen Verschaltungsregionen des adulten optischen Systems dar. Sie sind aus repetitiven Untereinheiten aufgebaut und zuständig für die Interpretation der Information der Lichtsinneszellen des Komplexauges.
Die Lamina des Komplexauges enthält je Cartridge fünf verschiedene Interneurone L1-L5, die sich in ihren Funktionen unterscheiden. In der Mitte jeder Cartridge liegen die Interneurone L1 und L2. Ihre Aufgabe ist es, Bewegungen wahrzunehmen. Das Interneuron L3 verknüpft die äußeren Photorezeptoren mit den Interneuronen der Medulla, die ebenfalls mit den Photorezeptoren R7 und R8 verbunden sind. Die einzelnen Cartridges werden untereinander durch L4-Neurone verbunden.[36]
Gliazellen sorgen für eine chemische und elektrische Isolation der Cartridges und teilen die Lamina in sechs Schichten ein, wovon jede einen charakteristischen Gliazelltyp aufweist.[37]
Die erste Schicht ist die fenestrierende Schicht, in der die Gliazellen Bündel aus Fotorezeptoren umhüllen, welche aus der Retina hervorgehen.
Die zweite Schicht ist die Pseudocartridge-Schicht, da Axonbündel hier eine den Cartridges ähnliche Form ausbilden. Die Gliazellen weisen eine lange, horizontal ausgedehnte Struktur auf.
In der dritten und vierten Schicht befindet sich die Satelliten-Glia. Diese Schichten kennzeichnen den Beginn des Lamina Cortex mit den Somata der monopolaren Neuronen L1-L5.
Die fünfte Schicht stellt das Lamina-Neuropil dar, in der Bündel aus Rezeptorterminalen und Interneuronen direkt von Gliazellen umhüllt sind. Zusätzlich bilden die Gliazellen Ausstülpungen in die Axone von R1-R6, was zum einen strukturellen Halt bietet und zum anderen einen regen metabolischen Austausch zwischen Glia und Neuron bewirkt.[38]
Die sechste Schicht ist die proximale Grenzschicht. Marginale Gliazellen bilden den Abschluss des Lamina-Neuropils und markieren damit die Wachstumsgrenze für die Axone von R1-R6. Die letzte Schicht wird nur noch von den Axonen der Fotorezeptoren R7 und R8 durchzogen, die direkt in die Medulla hineinreichen.[39]
Die Medulla besteht wie die Lamina aus Untereinheiten, die aufgrund ihrer Struktur als „Säulen“ bezeichnet werden. Horizontal wird die Medulla noch einmal in 10 Schichten (M1-M10) unterteilt, wobei die dickste Schicht als Serpentinschicht bezeichnet wird. Die Serpentinschicht unterteilt die Medulla in einen distalen und proximalen Teil. Innerhalb der Serpentinschicht verlaufen Tangentialneurone, die die vertikalen Säulen miteinander verbinden, deren Informationen verschalten und teilweise in das Zentralgehirn weiterleiten. Die Axone der L1-L5 Zellen der Lamina enden in der jeweils zugehörigen Säule in der Medulla, ebenso wie die Photorezeptorzellen R7 und R8. Zwischen der Lamina und der Medulla bilden die Axone ein Chiasma opticum.[40] So kommt in jeder Medullasäule die gebündelte Information von einem Punkt des Sichtfeldes an, indirekt über die monopolaren Zellen der Lamina (L1-L5) und direkt über die Rezeptorzellen R7 und R8. Ausgehend von den verschiedenen Schichten verlassen zwei Arten von Projektionsneuronen die Medulla. Hierbei handelt es sich um Transmedulla-Zellen des Typs Tm und TmY,[41] die verschiedene Säulen der Medulla mit der Lobula (Tm-Typ) oder mit Lobula und Lobula-Platte (TmY-Typ) verbinden und so ein zweites Chiasma opticum bilden.
Der Lobulakomplex, bestehend aus der anterior gelegenen Lobula und der posterior gelegenen Lobula-Platte, ist proximal zur Medulla positioniert und durch ein inneres Chiasma opticum mit ihr verbunden. Der Lobulakomplex stellt eine Verbindung der Medulla mit den visuellen Zentren des Zentralhirns dar, verknüpft also die visuelle Wahrnehmung mit dem Flugverhalten. Die Lobula leitet die erhaltene Bildinformation über den vorderen optischen Trakt zum Zentralhirn weiter, während die Lobulaplatte über Horizontal- und Vertikal-Zellen die jeweiligen Bewegungsinformationen weiterleitet.[42] Der Lobulakomplex hat eine direkte neuronale Verschaltung zum Flugapparat und kodiert richtungsabhängig die Bewegung von Reizmustern.[43]
Die Funktion des visuellen Systems bei D. melanogaster ist die Wahrnehmung und Verarbeitung visueller Information, sowie die Unterscheidung von Lichtverhältnissen bei Tag und Nacht. D. melanogaster kann sehr schnell fliegen. Deshalb muss das visuelle System eine sehr hohe zeitliche Auflösung, sowie eine gut organisierte Weiterleitung der Information leisten. Außerdem kann die Fliege auf mögliche Gefahrenquellen rechtzeitig reagieren und so ihr Überleben sichern. Das zeitliche Auflösungsvermögen liegt bei 265 Bildern pro Sekunde.
Die Fliege kann verschiedene Gegenstände anhand von unterschiedlichen Lichtspektren und Lichtintensitäten unterscheiden. Das spektrale Wahrnehmungsvermögen des Auges liegt zwischen 300 und 650 nm. Die 8 verschiedenen Photorezeptoren unterscheiden sich in den Absorptionsmaxima ihrer Photopigmente, den Rhodopsinen. Die in der Peripherie des Ommatidiums liegenden Photorezeptoren 1-6 (R1-6) exprimieren blau-grünes Rhodopsin 1 (Absorptionsmaximum bei 478 nm) und enthalten zusätzlich kurzwellige ultraviolett-sensitive Pigmente. Die Photorezeptoren 1-6 werden von schwachen Lichtintensitäten und Kontrasten aktiviert. Im Photorezeptor R7 befindet sich entweder Rh3 (345 nm) oder Rh4 (374 nm). Photorezeptor R8 exprimiert Blaulicht-empfindliche (Rh5, 437 nm) oder Grünlicht-empfindliche Rhodopsine (Rh6, 508 nm).[44]
Am dorsalen Rand des Auges exprimieren R7 und R8 Rhodopsin 3, das ultraviolettes Licht absorbiert. Dieser Bereich der Retina dient der Detektion des e-Vektors von polarisiertem Licht. Mit Hilfe des e-Vektors können die Fliegen sich an der Sonne orientieren. Im restlichen Teil der Retina befinden sich zwei Typen von Ommatidien, „pale (p)“ und „yellow (y)“. In der p-Typ Ommatide exprimiert R7 Rh3 und R8 blau-sensitives Rh5. Im y-Typ exprimiert R7 Rh4, das langwelliges UV-Licht absorbiert, und R8 das grün-sensitive Rh6.[45]
Lange wurde angenommen, dass die Photorezeptoren 1-6 ausschließlich für das Bewegungssehen und die Rezeptoren 7 und 8 für das Farbensehen zuständig sind. Fliegen, bei denen die Photorezeptoren 1-6 ausgeschaltet werden, zeigen eine geringe Reaktion in Bezug auf die Bewegung. Jedoch sind alle Photorezeptoren 1-8 am Bewegungssehen beteiligt.[46] Im frühen Larvenstadium ist das wichtigste Ziel der Larve das Fressen. Aus diesem Grund bleiben die Fresslarven innerhalb des Futters und weisen negative Phototaxis auf. Erst kurz vor der Metamorphose zeigen sie positive Phototaxis, die Wanderlarve verlässt die Nahrungsquelle, um sich außerhalb einen Platz zum Verpuppen zu suchen.
Endogene Uhren helfen lebenden Organismen, sich an tägliche Zyklen der Umgebung anzupassen. D. melanogaster verfügt wie viele andere Lebewesen auch über eine solche "innere Uhr". Dieses sogenannte circadiane System regelt unter anderem metabolische Prozesse, die Entwicklung sowie das Verhalten.
Bei D. melanogaster liegt die zentrale Uhr im Gehirn und besteht aus zwei lateralen und einer dorsalen Neuronengruppe pro Hemisphäre. Diese Neuronengruppen sind Teil des Protocerebrums. Die erste laterale Neuronengruppe (LN) besteht aus 5-8 dorsal liegenden Neuronen (LNd), die zweite Gruppe liegt ventral (LNv) und wird weiter unterteilt in 4-6 große LNv (l-LNv) und fünf kleine LNv (s-LNv). Die dritte Gruppe bilden die im Gehirn dorsal liegenden Neuronen (DN). Die dorsale Gruppe wird nach der Morphologie und Lokalisation der einzelnen Neuronen weiter unterteilt in etwa 15 DN1 und 2 DN2, die mittelgroß sind und posterior im dorsalen superioren Gehirn liegen. Etwa 40 kleine DN3 Zellen liegen lateral im dorsalen Gehirn. In der Larve findet man vier PDF-exprimierende (siehe Äußere Regulation/ circadiane Kontrolle von Verhalten) laterale Neuronen in jeder Hemisphäre (siehe Abb.1), die im adulten Tier den s-LNv entsprechen. Die l-LNv, LNd und DN entstehen während der Metamorphose. Bis auf die l-LNv projizieren alle Neuronengruppen ins dorsale Protocerebrum. Außerdem senden s-LNv, l-LNv, DN1 und DN3 Projektionen an die akzessorische Medulla. Die l-LNv verbinden die beiden akzessorischen Medullae miteinander über den posterioren optischen Trakt. Ein Ziel der Output-Bahnen der inneren Uhr könnten der Pilzkörper und der Zentralkomplex darstellen. Der Pilzkörper steht vermutlich unter rhythmischer Kontrolle der s-LNv Zellen, die einen circadianen Einfluss auf das Lernen und Gedächtnis haben könnten. Durch die LNd Zellen wird eine Innervation des Zentralkomplexes vermutet, der möglicherweise eine Umschaltstation für circadiane Signale bildet. Die Bewegungsaktivität wird ebenfalls durch circadiane Signale kontrolliert. s-LNv Zellen leiten die Signale an DN1 und DN2, wo sie umgeschaltet und an die Bewegungszentren weitergeleitet werden. Im Gegensatz dazu werden die Signale der LNd im Zentralkomplex umgeschaltet. Auch diese Signale werden weiter in den Bewegungszentren verarbeitet.[47]
Das Circadiane System kontrolliert unter anderem das Bewegungsverhalten, das im Tagesverlauf zwei Aktivitätshöhepunkte aufweist[47][48][49]. Unter Licht-Dunkel -Bedingungen (12 Stunden Licht und 12 Stunden Dunkelheit) sind bei ihr zwei lokomotorische Aktivitätshöhepunkte zum Morgen (ZT= 0) und zum Abend (ZT= 12) zu verzeichnen.[47][49] Diese Aktivitätshöhepunkte sind auch unter konstanten Bedingungen (z. B. Dunkel-Dunkel-Situation) zu beobachten. Der Tagesrhythmus bei Nullmutanten hingegen weist unter konstanten Bedingungen keine Rhythmik auf.[47] Werden sie Hell-Dunkel-Zyklen ausgesetzt, weisen sie jedoch eine Tagesrhythmik auf. Daraus lässt sich schließen, dass die Rhythmik in der lokomotorischen Aktivität auf die innere Uhr und auf das Tageslicht zurückzuführen ist.[48] Die circadiane Synchronisation erfolgt über zwei gekoppelte Oszillatoren, welche aus einem Netzwerk aus LNv und LNd bestehen.[47] Die LNv regulieren die Aktivität kurz vor der Morgendämmerung, die LNd hingegen die Aktivität vor der Abenddämmerung. Dabei spielt das Neuropeptid PDF, das in den s-LNv und l-LNv der beiden Hemisphären exprimiert wird, eine wichtige Rolle. PDF ist ein Outputsignal der inneren Uhr, das für eine rhythmische Aktivität bei einem 12-12h Licht-Dunkel-Zyklus notwendig ist. In Abwesenheit von PDF werden D. melanogaster bei dauerhafter Dunkelheit arhythmisch.[50]
Die Lichtsynchronisation erfolgt über den internen Photorezeptor Cryptochrom (CRY), der in fast allen Schrittmacherzellen vorkommt.[48] Zudem findet die Lichtperzeption auch durch die Facettenaugen, das Hofbauer-Buchner-Äuglein und die Ocellen statt.[48] Neben dem Licht können noch andere Faktoren als äußere Zeitgeber fungieren, z. B. Temperatur und Pheromone.
Einen zentralen Aspekt des circadianen Systems bei D. melanogaster stellt der hier kurz skizzierte Mechanismus dar: Um die innere Uhr bzw. den Tag-Nacht-Rhythmus aufrechtzuerhalten, besitzt D. melanogaster eine Reihe von Genen (engl. ‚clock–genes‘ Uhrengene), deren Expression im Tagesverlauf zyklisch schwankt. Zu den Uhrengenen, die in den Uhrenneuronen im Gehirn von D. melanogaster exprimiert werden, gehören Cycle (CYC), Clock (CLK), Period (PER) und Timeless (TIM).[51]
Die beiden Regulatorproteine Clock (CLK) und Cycle (CYC) können zusammen die Transkription der Gene period (per) und timeless (tim) aktivieren. Da das Protein TIM sehr lichtempfindlich ist und TIM PER stabilisiert, können diese beiden Proteine auch nur am Abend bzw. in der Nacht angehäuft werden.[52] Die Proteine PER und TIM bilden dann ein Dimer, das in den Kern wandert und daraufhin im Zellkern die Transkription der Gene Cycle und Clock hemmen kann[50] (siehe Bild). Es handelt sich hierbei also um einen positiven (clk, cyc) und negativen (per, tim) Feedback-Loop, wodurch eine cyclische Expression der Uhrengene gewährleistet wird.[52] Da dieser Mechanismus auf genetischer Ebene abläuft, spricht man hier auch von einem endogenen molekularen Oszillator.
Im larvalen Stadium weist D. melanogaster eine vom circadianen System regulierte negative Phototaxis auf, welche sich durch eine minimale Lichtsensitivität zu Ende des subjektiven Tages (CT= 12) und durch eine maximale Lichtsensitivität gegen subjektiven Morgen (CT= 0) auszeichnet. Evolutionsbiologisch dient dieses Verhalten der Larven wahrscheinlich dazu, Fressfeinde zu vermeiden.[53] Die adulte Fliege weist ebenfalls mehrere von der circadianen Uhr abhängige Verhaltensmuster auf, wie z. B. der Adultschlupf aus der Puppe, welcher zur Zeit des subjektiven Morgens (CT= 0) geschieht, um einen schnellen Wasserverlust zu verhindern.[54] Der Nahrungsaufnahmerhythmus wird sowohl durch Licht als auch durch die circadiane Uhr beeinflusst. Unter Licht-Dunkel-Bedingungen gibt es hierbei einen Nahrungsaufnahmehöhepunkt am Morgen (ZT = 0-2) und darauffolgend eine lange Phase stark verminderter Nahrungsaufnahme (ZT = 8-22). Unter Dunkel-Dunkel-Bedingungen kommt es zu einem Nahrungsaufnahmehöhepunkt von Morgen bis zum Mittag (CT = 0-6) und zu einer stark verminderter Nahrungsaufnahme am späten Tag bis frühen Abend (CT = 8-14).[55] Die Fähigkeit, ein olfaktorisches assoziatives Kurzzeitgedächtnis auszubilden, hat einen Höhepunkt zur Zeit der subjektiven frühen Nacht (CT = 13) und einen weiteren Höhepunkt kurz vor Mitternacht (CT= 17).[56] Die beste Wahrnehmung chemischer Geruchsstoffe, welche sich durch Elektroantennogramme darstellen lässt, findet während der subjektiven Nacht (CT=17) statt. Allerdings ist hierbei ein Zusammenhang zu bestimmten Verhaltensmustern unklar.[57] Das Immunsystem ist während des subjektiven Tages (Infektionszeitpunkt: CT = 5) anfälliger für Bakterieninfektion durch Pseudomonas aeruginosa und Staphylococcus aureus als während der subjektiven Nacht (Infektionszeitpunkt: CT = 17), in der im Falle einer Infektion eine erhöhte Expression von antimikrobiellen Peptiden (AMP) im Vergleich zu einer tagsüber stattfinden Infektion festzustellen ist.[58] Schließlich unterliegt das Balz- und Paarungsverhalten ebenfalls rhythmischen Schwankungen. Diese Schwankungen werden vor allem durch das Verhalten des Männchens bestimmt. Das Balz- und Paarungsverhalten weist einen Höhepunkt zur Zeit des subjektiven Morgens (CT = 0) und gegen Mitternacht (CT = 18), sowie einen Tiefpunkt zur Zeit des subjektiven Abends (CT = 12) auf.[59]
Das neuroendokrine System dient der Zell-Zell-Kommunikation. Es sendet Signale von Zellen des Nervensystems über hormonähnliche Botenstoffe an Zielzellen im Gewebe verschiedener Organe.[60] Das neuroendokrine System setzt sich aus neurosekretorischen Zellen zusammen, die in Neurohämalorgane oder neurohämale Zonen projizieren und von dort Botenstoffe (typischerweise Peptide) in die Zirkulation abgeben, um auf das Zielgewebe zu wirken.[61] Durch diese Eigenschaft unterscheiden sich die neurosekretorischen Zellen von gewöhnlichen Neuronen. Die Pars intercerebralis und die Pars lateralis sind dabei wichtige Zentren im dorso-medialen Protocerebrum, die solche neurosekretorischen Zellen beinhalten.[60]
In der Larve projizieren die Axone der sekretorischen Neurone der Pars intercerebralis und der Pars lateralis über die Nervi corporis cardiaci in die Ringdrüse. Im larvalen Stadium ist die Ringdrüse ein Komplex aus zwei endokrinen Drüsen, der Prothoraxdrüse sowie dem Corpus allatum, und einem neurohämalen Bereich, der paarigen Corpora cardiaca, die mit der Aorta assoziiert sind. Die Struktur der Ringdrüse verändert sich während der Metamorphose zum adulten Insekt (siehe Metamorphose).[62] Im larvalen Stadium kann man die Ringdrüse gut durch ihre auffallende Struktur, anterior zu den beiden Hirnhemisphären, erkennen. Durch die Nervi Corporis Cardiaci (NCC) ist die Ringdrüse mit dem larvalen Gehirn verbunden. Das größte Volumen in der Ringdrüse nimmt die Prothoraxdrüse ein. Die Zellen teilen und vergrößern sich mit fortschreitender Entwicklung der Larve. Innerhalb der Ringdrüse ist das Corpus Cardiacum ventral unpaarig angelegt und hat eine U-förmige Struktur. In ihrem glandulären Bereich wird das adipokinetische Hormon (AKH) produziert, das im Fettkörper den Abbau von Fetten und Kohlenhydraten stimuliert. In der Prothoraxdrüse wird die Synthese des Steroidhormons Ecdyson durch PTTH (Prothorakotropisches Hormon) aktiviert. Ecdyson ist unter anderem für die adulte Häutung und in Kombination mit dem Juvenilhormon für die larvale Häutung verantwortlich. Das Corpus allatum synthetisiert das Juvenilhormon.[63] In jeder Gehirnhemisphäre findet man fünf Neurone des lateralen Protocerebrums, die die beiden endokrinen Drüsen innervieren. Diese befinden sich in enger Nachbarschaft zu Axonen der circadianen Schrittmacherneurone. Diese Verbindung ist möglicherweise für den circadianen Rhythmus von Häutung und Metamorphose verantwortlich. Außerdem wurde ein ventromediales Neuron gefunden, das die Ringdrüse innerviert und für die Produktion des Schlupfhormons (Eclosionshormon) verantwortlich ist.[64]
Die perisympathischen Organe (PSO) sind neurohämale Organe, die als Verdickungen am medianen und transversalen Nerv auftreten. In der D. melanogaster Larve findet man sie assoziiert mit den drei thorakalen Neuromeren sowie den abdominalen Neuromeren A2 – A4. Die thorakalen PSO werden jeweils durch ein Zellpaar von Tv-Neuronen, die abdominalen PSO jeweils durch ein Zellpaar von Va-Neuronen im gleichen Neuromer innerviert. Während der Metamorphose verschwinden die PSO und die innervierenden peptidergen Neuriten werden in das ventrale Ganglion mit eingebunden. Ihre Terminalen liegen nach der Metamorphose zwischen dem Zellkörpercortex und der das Nervensystem umhüllenden Glia, wo sie eine neurohämale Zone bilden.[65]
Quelle[66]
In D. melanogaster wurden mindestens 42 verschieden codierende Gene für Vorstufen von Neuropeptiden, Peptidhormonen und Proteinhormonen gefunden. Die meisten Peptidhormone aktivieren G-Protein-gekoppelte Rezeptoren (GPCRs). Es wurden mind. 45 Neuropeptide, Peptid- und Proteinhormone GPCRs identifiziert. Jedes Neuropeptidgen besitzt spezifische Expressionsmuster im larvalen und adulten Nervensystem von D. melanogaster. Neuropeptide können von verschiedenen Neuronentypen produziert werden. Hierzu gehören bei D. melanogaster die olfaktorischen Rezeptorneurone, verschiedene Typen von Interneuronen, neurosekretorische Zellen, Motoneurone und sekretorische Neurone.[66]
Der basische Helix-Loop-Helix (bHLH) Transkriptionsfaktor DIMMED ist ein entscheidender Regulator bei der neuroendokrinen Zelldifferenzierung. Er wird selektiv in den neuroendokrinen Zellen exprimiert und ist anscheinend für die Koordination ihrer molekularen und zellulären Eigenschaften zuständig. Es kommt zu einer transkriptionellen Kontrolle, wobei dies zum Einschlagen des regulierten sekretorischen Weges führt. Der Transkriptionsfaktor versetzt die Zelle in die Lage, LDCVs (large dense-core vesicles) auszubilden und anzuhäufen. Diese Vesikel können Neuropeptide speichern und nach Erhöhung der freien Intrazellulären Calciumkonzentration sezernieren. Zum anderen aktiviert DIMM den kompletten post-translationalen Verarbeitungsprozess von Neuropeptiden. Dadurch können biologisch aktive Peptide aus den Präpropeptiden hergestellt werden. DIMM kann Eigenschaften von neuroendokrinen Zellen auf Neuronen übertragen, die sonst nicht diesem Typ angehören: Nicht-peptiderge Neuronen häufen normalerweise keine ektopischen Neuropeptide an. Nach ektopischer Expression von DIMM können sie dies jedoch. Es gibt peptiderge Neurone, die kein DIMM exprimieren, dabei handelt es sich um Interneurone. Bei einer Überexpression im Wildtyp erhöht sich sowohl das Level an sekretorischen Peptiden in neuroendokrinen Zellen, als auch die Anzahl an Zellen, die einen neuroendokrinen Phänotyp aufweisen.[67]
Die Metamorphose in D. melanogaster wird vom Wechselspiel zwischen Ecdyson und Juvenilhormon gesteuert. Ist eine hohe Konzentration an Juvenilhormon in der Larve vorhanden, induzieren Ecdysteroide eine Larvenhäutung. Das Juvenilhormon fördert das Larvenwachstum und hemmt die Metamorphose. Liegt eine niedrige Konzentration an diesem Hormon vor, geht die Larve Ecdyson-induziert zur Puppenhäutung über. Ist kein Juvenilhormon mehr vorhanden, jedoch eine hohe Konzentration von Ecdyson, wird die Imaginalhäutung eingeleitet.
Veränderungen der Ringdrüse während der Metamorphose
Die endokrinen Drüsen der Ringdrüse durchlaufen während der Metamorphose drastische Veränderungen. Nach dem Beginn der Verpuppung wandert die Ringdrüse von ihrer Position oberhalb der Gehirnhemisphären zum Ösophagus bis kurz vor den Vormagen (Proventriculus). Eine neue Basallamina legt sich um die einzelnen Teile der Ringdrüse. Die Prothoraxdrüse separiert sich von dem Corpus Allatum und von dem Corpus Cardiacum. Das Corpus Cardiacum verschmilzt mit dem Hypocerebralganglion zu einem Komplex. Zum Ende der Metamorphose nimmt die Ecdyson-Biosynthese ab, da die Prothoraxdrüse degeneriert. 24 Stunden nach der Verpuppung fangen die Prothoraxdrüsenzellen an kleiner zu werden, sich voneinander zu entfernen und leiten schließlich den Zelltod ein. Nur die Zellen der Prothoraxdrüse degenerieren. Corpus Allatum und Corpus Cardiacum dagegen findet man auch im adulten Tier wieder.[68]
Je nach Lebensbedingungen lebt die Taufliege 2-8 Wochen. Die Lebensdauer bei Männchen beträgt allerdings nur ca. 10 Tage.[69] Das Altern in D. melanogaster wird durch Hormone gesteuert. Darunter fallen besonders Ecdyson und Juvenilhormon, die die Seneszenz beeinflussen. Mutationen im Insulin-Signalweg verlängern die Lebensdauer in D. melanogaster und beeinflussen den Hormonspiegel anderer Hormone, darunter besonders Juvenilhormon und Ecdyson. Entfernt man das endokrine Gewebe des JH-produzierenden Corpus Allatum, verlängert sich das Überleben der Fliegen und die Sterblichkeit wird reduziert. Adulte Fliegen, die mit Juvenilhormon behandelt wurden, weisen eine erhöhte Sterblichkeit auf. Daraus folgt, dass das Alter, zumindest zum Teil, durch die neuroendokrine Kontrolle von Juvenilhormon reguliert wird. Diapause in adulten Fliegen verzögert eine Seneszenz und kann die Überlebensrate erhöhen. In Versuchen verlangsamten induzierte Diapausen das Altern. Alter und Sterblichkeit sind von der neuronalen Regulation des Juvenilhormons abhängig. Die neuroendokrine Antwort ist unter anderem abhängig von der Umwelt, die wiederum das Altern beeinflusst.[70]
D. melanogaster wurde in der ersten Hälfte des 20. Jahrhunderts durch die Forschungen des amerikanischen Zoologen und Genetikers Thomas Hunt Morgan und seiner Schule zum Versuchstier der klassischen Genetik. Diese Art hat nur vier verschiedene Chromosomen, die in den D. melanogaster-Zellen paarweise vorkommen: ein Paar Geschlechtschromosomen, die auch als erstes Chromosom oder X- bzw. Y-Chromosom bezeichnet werden, und drei Paar Autosomen, die als zweites, drittes und viertes Chromosom bezeichnet werden. Das vierte Chromosom ist jedoch nur sehr klein und enthält nur wenige Gene. Ideal für die Forschung ist auch, dass die Zucht einer großen Anzahl von Fliegen in Flaschen leicht möglich und die Generationenfolge kurz ist. „Eine halbe Milchtüte mit einem Stück verfaulender Banane genügte, um zweihundert Taufliegen vierzehn Tage lang bei Laune zu halten“, schreibt Martin Brookes in seinem 2002 erschienenen Buch über Drosophila. So hat man eine sehr große Anzahl von Kreuzungsexperimenten mit den Taufliegen durchführen können. Dabei wurden Kopplungsgruppen von Genen, die auf ein und demselben Chromosom sitzen, festgestellt, das Phänomen des Crossing Over entdeckt und auch etliche Mutanten beschrieben und näher untersucht, etwa Fliegen mit weißen statt mit roten Augen oder Exemplare mit Stummelflügeln, die flugunfähig sind. Hermann Muller war der erste, der die mutationsauslösende Wirkung von Röntgenstrahlen auf die Erbsubstanz der Taufliege erkannte. Seitdem wurden die harten Strahlen eingesetzt, um bei den Fliegen eine Vielzahl von unterschiedlichen Mutationen auszulösen.
Die Popularität von D. melanogaster als Modellorganismus hielt zunächst bis in die 1940er Jahre an.
Mit Drosophila synthetica existiert eine genetisch modifizierte Variante, die im Labor derartig stark verändert wurde, dass sie als eigene Art angesehen werden kann.
Im Jahr 2000 wurde die Sequenzierung des Genoms abgeschlossen. Insgesamt 139.731.881 Basenpaare und etwa 13.600 unterschiedliche Gene wurden dabei ermittelt. Diese erste Schätzung muss nach zehn Jahren revidiert werden, da man inzwischen 19.806 Gene kennt. Viele dieser Gene haben zum Teil erstaunliche Ähnlichkeit mit den Genen des Menschen. Forscher haben herausgefunden, dass etwa 70 Prozent der menschlichen Gene, die im Zusammenhang mit Krebs beschrieben wurden und im Verdacht stehen, in mutiertem Zustand an der Krebsentstehung beteiligt zu sein, auch im Erbgut der Taufliege vorkommen.[71][72][73]
Auch im Rahmen entwicklungsbiologischer Untersuchungen hat man an den Embryonalstadien der Taufliegen zahlreiche Erkenntnisse gewinnen können. Schon um 1900 war der Harvard-Professor William Ernest Castle der erste, der auf der Suche nach einem Organismus, der sich als Objekt für embryologische Studien eignete, auf die Taufliege stieß. Seitdem hat sich auf diesem Gebiet viel getan. In den 1970er Jahren begann sich Christiane Nüsslein-Volhard mit den Entwicklungsgenen von D. melanogaster zu beschäftigen. Die Entwicklung der Fliege vom Ei bis zum Imago wird über eine Genkaskade verschiedener Gengruppen gesteuert. Dabei beeinflussen die früher in dieser Genkaskade auftretenden Gengruppen jeweils die zeitlich nachfolgenden, nicht jedoch umgekehrt. An erster Stelle stehen die bereits während der Oogenese in Eizelle, Nährzellen und Follikelzellen exprimierten maternalen Koordinatengene. Auf diese folgen während der larvalen Entwicklung zuerst die Lückengene, dann die Paarregelgene und schließlich die Segmentpolaritätsgene. Die homöotischen Gene sorgen zuletzt für die Entwicklung der Organe in den entsprechenden Segmenten. 1980 veröffentlichte sie ihre bahnbrechende Studie über die „Mutationen, die Zahl und Polarität der Segmente bei D. melanogaster beeinflussen“, für die sie 1995 zusammen mit Eric Wieschaus und Edward Lewis den Nobelpreis für Physiologie oder Medizin erhielt.
D. melanogaster ist eine Fliegenart, die sehr einfach und billig zu züchten ist. In der Genforschung wird D. melanogaster bevorzugt als Forschungsobjekt verwendet, weil sie eine kurze Generationsfolge (etwa 9–14 Tage) aufweist, aus einer Generation bis zu 400 Nachkommen entspringen, jedes Individuum nur vier Chromosomenpaare besitzt und weil die Art viele leicht erkennbare Genmutationen zeigt. Mit dem Gal4/UAS-System steht ein genetisches Werkzeug zur Verfügung, welches die Expression beliebiger Gene in spezifisch ausgewählten Zellen erlaubt.
Neben der Verwendung in der Genetik ist D. melanogaster auch als Futtertier beliebt, zum Beispiel zur Fütterung von Fischen oder kleinen Reptilien und Amphibien. Dabei werden vor allem flugunfähige Mutanten verwendet, weil sie einfacher zu handhaben sind.
In den USA findet in wechselnden Städten jährlich die größte internationale Drosophila-Konferenz statt. Sie hat etwa 2000 Teilnehmer. Die europäische Drosophila-Konferenz hat im Schnitt 400 bis 500 Teilnehmer und findet alle zwei Jahre in wechselnden europäischen Ländern statt. Eine kleine deutsche regionale Tagung gibt es jährlich. Des Weiteren ist D. melanogaster als Forschungsobjekt auf vielen internationalen Life Science-, Entwicklungsbiologie-, Neurobiologie- und weiteren Tagungen vertreten.
Die Züchtungen in den wissenschaftlichen Laboratorien haben eine Unzahl von Mutationen hervorgebracht. In systematischen Screens wurde inzwischen ein Großteil der etwa 13400 Gene mutiert.
Drosophila melanogaster (von altgriechisch δρόσος drosos „Tau“, φίλος philos „liebend“, μέλας melas „schwarz“ und γαστήρ gaster „Bauch“) ist eine von über 3000 Arten aus der Familie der Taufliegen (Drosophilidae). Sie ist einer der am besten untersuchten Organismen der Welt. Die recht ungebräuchlichen deutschen Bezeichnungen Schwarzbäuchige Fruchtfliege oder Schwarzbäuchige Taufliege für dieses Tier sind relativ neu und tauchen in der deutschsprachigen Literatur erst nach 1960 auf. Als „Fruchtfliegen“ wurden im fachlichen deutschen Sprachgebrauch ursprünglich nicht die Vertreter der Familie der Drosophilidae, sondern nur der Tephritidae bezeichnet.
Drosophila melanogaster (synonym unter anderem mit Drosophila ampelophila Loew) wurde erstmals 1830 von Johann Wilhelm Meigen beschrieben. Als geeigneten Versuchsorganismus nutzte sie 1901 zuerst der Zoologe und Vererbungsforscher William Ernest Castle. Er untersuchte an D.-melanogaster-Stämmen die Wirkung von Inzucht über zahlreiche Generationen und die nach Kreuzung von Inzuchtlinien auftretenden Effekte. 1910 begann Thomas Hunt Morgan ebenfalls, die Fliegen im Labor zu züchten und systematisch zu untersuchen. Seitdem haben viele andere Genetiker an diesem Modellorganismus wesentliche Erkenntnisse zur Anordnung der Gene in den Chromosomen des Genoms dieser Fliege gewonnen.
Drosophila melanogaster es un specie de Drosophila. Illo es communmente appellate le "musca del fructo" e es multo usate in recerca per biologistas. Octo Premios Nobel ha essite ganiate pro recerca que usava D. melanogaster.[1]
La Drosophila melanogaster (aperada mei simplament drosofila o mosca deu vinagre) qu'ei ua mosca (diptèr) hèra comunament emplegat peus experiments genetics. Qu'ei, per aquesta rason, un deus insèctes los mei estudiats per l'òmi (com ac son tanben Escherishia coli en çò deus bacteris e lo milhòc e lo tobac en çò de las plantas).
Un deus avantage d'emplegar ua tau mosca com organime modèu qu'ei la repiditat deu son cicle de generacion (2 setmanas, haut o baish) e la quantitat d'individús sus cada generacion (de cap a 400 uèus)qui ajuda a hargoar resultas estatisticas significativas.
Ang Drosophila melanogaster ay isang uri ng lumipad sa pamilya Drosophilidae. Ang uri ng hayop ay karaniwang kilala bilang karaniwang lumipad ng prutas o suka ng langis. Simula sa panukala ni Charles W. Woodworth sa paggamit ng species na ito bilang isang modelo ng organismo, ang D. melanogaster ay patuloy na malawakang ginagamit para sa biological na pananaliksik sa henetika, pisyolohiya, microbial pathogenesis, at ebolusyon ng kasaysayan ng buhay.
![]() Ang lathalaing ito ay isang usbong. Makatutulong ka sa Wikipedia sa nito.
Ang lathalaing ito ay isang usbong. Makatutulong ka sa Wikipedia sa nito.
Drosophila melanogaster ya iku salah sawijiné jinis gegremet kang nduwé suwiwi lan kalebu ing ordho Diptera (bangsanè laler).[2] Drosophila melanogaster iku laler kang asring tinemu ing woh-wohan kang wis bosok, mula uga diarani lalat buah (laler woh).[2] Drosophila wis digunakaké taun-taunan ing kajian genetika lan tindak-tanduk kéwan.[2]
Drosophila melanogaster ya iku salah sawijiné jinis gegremet kang nduwé suwiwi lan kalebu ing ordho Diptera (bangsanè laler). Drosophila melanogaster iku laler kang asring tinemu ing woh-wohan kang wis bosok, mula uga diarani lalat buah (laler woh). Drosophila wis digunakaké taun-taunan ing kajian genetika lan tindak-tanduk kéwan.
Rametuk (Drosophila melanogaster) mangrupa jenis laleur buah, kaasup kana filum Artropoda kelas Insekta bangsa Diptera, anak bangsa Cyclophorpha (pangelompokkan laleur anu pupa na aya kulit instar 3, mibanda jaw hooks), seri Acaliptrata (imago megar ku cara kaluar tina bagian interior pupa), suku Drosophilidae, jenis Drosophila melanogester di Indonésia aya antara 600 jenis, pulo jawa antara 120 jenis tina suku drosophilidae.[1]
Rametuk (Drosophila melanogaster) mangrupa jenis laleur buah, kaasup kana filum Artropoda kelas Insekta bangsa Diptera, anak bangsa Cyclophorpha (pangelompokkan laleur anu pupa na aya kulit instar 3, mibanda jaw hooks), seri Acaliptrata (imago megar ku cara kaluar tina bagian interior pupa), suku Drosophilidae, jenis Drosophila melanogester di Indonésia aya antara 600 jenis, pulo jawa antara 120 jenis tina suku drosophilidae.
Vinska mušica ili voćna mušica, u Bosni poznata i kao komarica i odomaćeno kao drozofila (lat. Drosophila melanogaster) je insekt reda dvokrilaca (Diptera), porodica Drosophilidae.[1][2][3]
Voćna mušica je neugledni, sitni dvokrilni insekt, koji obično živi na trulećem voću, povrću i ostalim podlogama u kojima se odvijaju procesi alkoholne fermentacije. Hrani se živim ćelijama kvasca. U prirodnim populacijama, tijelo joj je žućkasto do svijetlosmeđe, a oči ciglaste. Duga je 3–5 mm. Za samo petnaestak dana, na sobnoj temperaturi, odvija se proces potpune metamorfoze: jaje – larva – lutka – odrasla jedinka.
Osim obične, postoji i mnogo drugih vrsta voćnih mušica, ali vinska je daleko najpoznatija, jer se često, kao modelni organizam, koristi u laboratorijskim istraživanjima, od molekulske do evolucijske genetike.
Među 8.500 jedinki koje su svojevremeno prikupljene iz buradi sa komom ili džibrom za proizvodnju vina i rakije, u 16 naseljenih mjesta širom Bosne i Hercegovine, registrirano šest vrsta roda Drosophila: D. melanogaster, D. busckii, D. funebris, D. hydei, D. immigrans i D. simulans.[4][5]
Na temperaturi od 20 °C, od polaganja jaja do izlijetanja odraslih prođe oko 15 dana, a na 25 °C, svega 10 dana. Na temperaturama od 5-6 °C samo stupanja larve traje oko 60 dana, a na 0 °C – proces razvića se zaustavlja. Temperature više od optimalnih, međutim, djeluju na sposobnost razmnožavanja. Tako već na 33 °C mužjaci gube plodnost.
Jaja ženka polaže već nakod dva sata iza oplodnje. Svaka ženka prosječno dnevno položi 50-70 bijelih jaja, maksimalno 500 tokom prvih 10 dana. Kasnije broj dnevno položenih jaja opada, tako da u toku života (najviše 35-40 dana) ženka ih položi do 1.000 komada. Jaja su mala (duga do 5 mm), ovalna, sa dva filamenta. U vrijeme polaganja razviće je već u toku.
Larva je u početku bijela, a kasnije požuti. Izražena joj je regionalna segmentiranost na glavu (jedan segment), grudi (tri segmenta) i abdimen (8 segmenata). Larva raste, presvlači se tri puta, a pred zakukuljenje doseže dužinu do 5 mm.
Lutka (kukuljica), u početku je žuta, a kasnije dobija smeđu nijansu. Dosegne dužinu do 3–5 mm, a njena silueta podsjeća na sovu ušaru.
Odrasle jedinke (adulti ili imaga) imaju sve odlike dvokrilaca i dužinu do 5 mm.
Drozofila je jedna od prvih laboratorijskih životinja, koja ispunjava sva poželjna svojstva modelnih organizama:
Svaka ženka vinske mušice, u povoljnim uvjetima, može proizvesti par hiljada potomaka. Postoje proračuni da bi potomstvo jednog para vinske mušice, ukoliko bi preživjele sve jedinke, svih sukcesivnih genetacija, tokom jedne kalendarske odine, pokrilo površinju zemaljske kugle.
Podobnost eksperimentalnog uzgoja vinske mušice je i u:
U pjuvačnim žlijezdama vinske mušice nalaze se neobičajeno veliki tzv. džinovski ili politeni, hromosomi. Nakon specifičnog bojenja, dobro su vidljivi pod svjetlosnim mikroskopom, a naziru se čak i pod običnom lupom. Zbog toga je voćna mušica gotovo idealna za genetička istraživanja, osobito za proučavanje mutacija i interakcije gena. Danas postoji na hiljade prirodnih i laboratorijskih mutanata vinskih mušica. Naprimjer, mutirana vinska mušica, umjesto normalnih krila, može imati samo patrljke (vestigijalna krila) ili nesimetrična, umjesto normalnih krila, tamno tijelo umjesto žuto-smeđeg, i bijele oči, ciglaste cinober, „kardinal“ ili smeđe, umjesto crveno-ciglastih očiju.
Charles W. Woodworth se smatra prvim uzgajivačem vinske mušice za potrebe naučnih istraživanja. Time se ozbiljnije počeo baviti Thomas Hunt Morgan 1910. godine, a nakon toga praktično cijeli istraživački vijek proveo istražujući različite aspekte genetike ovog dvokrilca. Za vrijeme boravka na University of Columbia, Morgan je uspio pokazati kako se geni prenose na hromosomima i da su oni mehanička osnova nasljeđivanja. Time je postavio osnove za razvoj moderne genetike, za koje je 1933. dobio Nobelovu nagradu za fiziologiju i medicinu.
Vinska mušica ili voćna mušica, u Bosni poznata i kao komarica i odomaćeno kao drozofila (lat. Drosophila melanogaster) je insekt reda dvokrilaca (Diptera), porodica Drosophilidae.
Drosophila melanogaster esti una ispètzia de musca (de su ordini tassonomicu Diptera) de sa familia Drosophilidae. S' ispètzia esti connotta cummenti su muschitu de sa fruta e esti imperada in biologia po esperimentus sientificus in genetica, fisiologia, evolutzioni.
Drosophila melanogaster esti una ispètzia de musca (de su ordini tassonomicu Diptera) de sa familia Drosophilidae. S' ispètzia esti connotta cummenti su muschitu de sa fruta e esti imperada in biologia po esperimentus sientificus in genetica, fisiologia, evolutzioni.
Drosophila melanogaster is a species of fly (the taxonomic order Diptera) in the family Drosophilidae. The species is often referred to as the fruit fly or lesser fruit fly, or less commonly the "vinegar fly" or "pomace fly".[a][4] Starting with Charles W. Woodworth's 1901 proposal of the use of this species as a model organism,[5][6] D. melanogaster continues to be widely used for biological research in genetics, physiology, microbial pathogenesis, and life history evolution. As of 2017, five Nobel Prizes have been awarded to drosophilists for their work using the insect.[7][8]
D. melanogaster is typically used in research owing to its rapid life cycle, relatively simple genetics with only four pairs of chromosomes, and large number of offspring per generation.[9] It was originally an African species, with all non-African lineages having a common origin.[10] Its geographic range includes all continents, including islands.[11] D. melanogaster is a common pest in homes, restaurants, and other places where food is served.[12]
Flies belonging to the family Tephritidae are also called "fruit flies". This can cause confusion, especially in the Mediterranean, Australia, and South Africa, where the Mediterranean fruit fly Ceratitis capitata is an economic pest.
Wild type fruit flies are yellow-brown, with brick-red eyes and transverse black rings across the abdomen. The black portions of the abdomen are the inspiration for the species name (melanogaster = "black-bellied"). The brick-red color of the eyes of the wild type fly are due to two pigments:[13] xanthommatin, which is brown and is derived from tryptophan, and drosopterins, which are red and are derived from guanosine triphosphate.[13] They exhibit sexual dimorphism; females are about 2.5 mm (0.10 in) long; males are slightly smaller with darker backs. Males are easily distinguished from females based on colour differences, with a distinct black patch at the abdomen, less noticeable in recently emerged flies, and the sexcombs (a row of dark bristles on the tarsus of the first leg). Furthermore, males have a cluster of spiky hairs (claspers) surrounding the reproducing parts used to attach to the female during mating. Extensive images are found at FlyBase.[14] Drosophila melanogaster flies can sense air currents with the hairs on their backs. Their eyes are sensitive to slight differences in light intensity and will instinctively fly away when a shadow or other movement is detected.[15]
Under optimal growth conditions at 25 °C (77 °F), the D. melanogaster lifespan is about 50 days from egg to death.[16] The developmental period for D. melanogaster varies with temperature, as with many ectothermic species. The shortest development time (egg to adult), 7 days, is achieved at 28 °C (82 °F).[17][18] Development times increase at higher temperatures (11 days at 30 °C or 86 °F) due to heat stress. Under ideal conditions, the development time at 25 °C (77 °F) is 8.5 days,[17][18][19] at 18 °C (64 °F) it takes 19 days[17][18] and at 12 °C (54 °F) it takes over 50 days.[17][18] Under crowded conditions, development time increases,[20] while the emerging flies are smaller.[20][21] Females lay some 400 eggs (embryos), about five at a time, into rotting fruit or other suitable material such as decaying mushrooms and sap fluxes. Drosophila melanogaster is a holometabolous insect, so it undergoes a full metamorphosis. Their life cycle is broken down into 4 stages: embryo, larva, pupa, adult.[22] The eggs, which are about 0.5 mm long, hatch after 12–15 hours (at 25 °C or 77 °F).[17][18] The resulting larvae grow for about 4 days (at 25 °C) while molting twice (into second- and third-instar larvae), at about 24 and 48 h after hatching.[17][18] During this time, they feed on the microorganisms that decompose the fruit, as well as on the sugar of the fruit itself. The mother puts feces on the egg sacs to establish the same microbial composition in the larvae's guts that has worked positively for herself.[23] Then the larvae encapsulate in the puparium and undergo a 4-day-long metamorphosis (at 25 °C), after which the adults eclose (emerge).[17][18]
Males perform a sequence of five behavioral patterns to court females. First, males orient themselves while playing a courtship song by horizontally extending and vibrating their wings. Soon after, the male positions himself at the rear of the female's abdomen in a low posture to tap and lick the female genitalia. Finally, the male curls his abdomen and attempts copulation. Females can reject males by moving away, kicking, and extruding their ovipositor.[24] Copulation lasts around 15–20 minutes,[25] during which males transfer a few hundred, very long (1.76 mm) sperm cells in seminal fluid to the female.[26] Females store the sperm in a tubular receptacle and in two mushroom-shaped spermathecae; sperm from multiple matings compete for fertilization. A last male precedence is believed to exist; the last male to mate with a female sires about 80% of her offspring. This precedence was found to occur through both displacement and incapacitation.[27] The displacement is attributed to sperm handling by the female fly as multiple matings are conducted and is most significant during the first 1–2 days after copulation. Displacement from the seminal receptacle is more significant than displacement from the spermathecae.[27] Incapacitation of first male sperm by second male sperm becomes significant 2–7 days after copulation. The seminal fluid of the second male is believed to be responsible for this incapacitation mechanism (without removal of first male sperm) which takes effect before fertilization occurs.[27] The delay in effectiveness of the incapacitation mechanism is believed to be a protective mechanism that prevents a male fly from incapacitating his own sperm should he mate with the same female fly repetitively. Sensory neurons in the uterus of female D. melanogaster respond to a male protein, sex peptide, which is found in semen.[28] This protein makes the female reluctant to copulate for about 10 days after insemination. The signal pathway leading to this change in behavior has been determined. The signal is sent to a brain region that is a homolog of the hypothalamus and the hypothalamus then controls sexual behavior and desire.[28] Gonadotropic hormones in Drosophila maintain homeostasis and govern reproductive output via a cyclic interrelationship, not unlike the mammalian estrous cycle.[29] Sex peptide perturbs this homeostasis and dramatically shifts the endocrine state of the female by inciting juvenile hormone synthesis in the corpus allatum.[30]
D. melanogaster is often used for life extension studies, such as to identify genes purported to increase lifespan when mutated.[31] D. melanogaster is also used in studies of aging. Werner syndrome is a condition in humans characterized by accelerated aging. It is caused by mutations in the gene WRN that encodes a protein with essential roles in repair of DNA damage. Mutations in the D. melanogaster homolog of WRN also cause increased physiologic signs of aging, such as shorter lifespan, higher tumor incidence, muscle degeneration, reduced climbing ability, altered behavior and reduced locomotor activity.[32]
Females become receptive to courting males about 8–12 hours after emergence.[33] Specific neuron groups in females have been found to affect copulation behavior and mate choice. One such group in the abdominal nerve cord allows the female fly to pause her body movements to copulate.[28] Activation of these neurons induces the female to cease movement and orient herself towards the male to allow for mounting. If the group is inactivated, the female remains in motion and does not copulate. Various chemical signals such as male pheromones often are able to activate the group.[28]
Also, females exhibit mate choice copying. When virgin females are shown other females copulating with a certain type of male, they tend to copulate more with this type of male afterwards than naïve females (which have not observed the copulation of others). This behavior is sensitive to environmental conditions, and females copulate less in bad weather conditions.[34]
D. melanogaster males exhibit a strong reproductive learning curve. That is, with sexual experience, these flies tend to modify their future mating behavior in multiple ways. These changes include increased selectivity for courting only intraspecifically, as well as decreased courtship times.
Sexually naïve D. melanogaster males are known to spend significant time courting interspecifically, such as with D. simulans flies. Naïve D. melanogaster will also attempt to court females that are not yet sexually mature, and other males. D. melanogaster males show little to no preference for D. melanogaster females over females of other species or even other male flies. However, after D. simulans or other flies incapable of copulation have rejected the males' advances, D. melanogaster males are much less likely to spend time courting nonspecifically in the future. This apparent learned behavior modification seems to be evolutionarily significant, as it allows the males to avoid investing energy into futile sexual encounters.[35]
In addition, males with previous sexual experience modify their courtship dance when attempting to mate with new females—the experienced males spend less time courting, so have lower mating latencies, meaning that they are able to reproduce more quickly. This decreased mating latency leads to a greater mating efficiency for experienced males over naïve males.[36] This modification also appears to have obvious evolutionary advantages, as increased mating efficiency is extremely important in the eyes of natural selection.
Both male and female D. melanogaster flies act polygamously (having multiple sexual partners at the same time).[37] In both males and females, polygamy results in a decrease in evening activity compared to virgin flies, more so in males than females.[37] Evening activity consists of those in which the flies participate other than mating and finding partners, such as finding food.[38] The reproductive success of males and females varies, because a female only needs to mate once to reach maximum fertility.[38] Mating with multiple partners provides no advantage over mating with one partner, so females exhibit no difference in evening activity between polygamous and monogamous individuals.[38] For males, however, mating with multiple partners increases their reproductive success by increasing the genetic diversity of their offspring.[38] This benefit of genetic diversity is an evolutionary advantage because it increases the chance that some of the offspring will have traits that increase their fitness in their environment.
The difference in evening activity between polygamous and monogamous male flies can be explained with courtship. For polygamous flies, their reproductive success increases by having offspring with multiple partners, and therefore they spend more time and energy on courting multiple females.[38] On the other hand, monogamous flies only court one female, and expend less energy doing so.[38] While it requires more energy for male flies to court multiple females, the overall reproductive benefits it produces has kept polygamy as the preferred sexual choice.[38]
The mechanism that affects courtship behavior in Drosophila is controlled by the oscillator neurons DN1s and LNDs.[39] Oscillation of the DN1 neurons was found to be effected by sociosexual interactions, and is connected to mating-related decrease of evening activity.[39]
D. melanogaster remains one of the most studied organisms in biological research, particularly in genetics and developmental biology. It is also employed in studies of environmental mutagenesis.

D. melanogaster was among the first organisms used for genetic analysis, and today it is one of the most widely used and genetically best-known of all eukaryotic organisms. All organisms use common genetic systems; therefore, comprehending processes such as transcription and replication in fruit flies helps in understanding these processes in other eukaryotes, including humans.[40]
Thomas Hunt Morgan began using fruit flies in experimental studies of heredity at Columbia University in 1910 in a laboratory known as the Fly Room. The Fly Room was cramped with eight desks, each occupied by students and their experiments. They started off experiments using milk bottles to rear the fruit flies and handheld lenses for observing their traits. The lenses were later replaced by microscopes, which enhanced their observations. Morgan and his students eventually elucidated many basic principles of heredity, including sex-linked inheritance, epistasis, multiple alleles, and gene mapping.[40]
D. melanogaster had historically been used in laboratories to study genetics and patterns of inheritance. However, D. melanogaster also has importance in environmental mutagenesis research, allowing researchers to study the effects of specific environmental mutagens.[41]
There are many reasons the fruit fly is a popular choice as a model organism:

Genetic markers are commonly used in Drosophila research, for example within balancer chromosomes or P-element inserts, and most phenotypes are easily identifiable either with the naked eye or under a microscope. In the list of a few common markers below, the allele symbol is followed by the name of the gene affected and a description of its phenotype. (Note: Recessive alleles are in lower case, while dominant alleles are capitalised.)
Drosophila genes are traditionally named after the phenotype they cause when mutated. For example, the absence of a particular gene in Drosophila will result in a mutant embryo that does not develop a heart. Scientists have thus called this gene tinman, named after the Oz character of the same name.[45] Likewise changes in the Shavenbaby gene cause the loss of dorsal cuticular hairs in Drosophila sechellia larvae.[46] This system of nomenclature results in a wider range of gene names than in other organisms.
The genome of D. melanogaster (sequenced in 2000, and curated at the FlyBase database[42]) contains four pairs of chromosomes – an X/Y pair, and three autosomes labeled 2, 3, and 4. The fourth chromosome is relatively very small and therefore often ignored, aside from its important eyeless gene. The D. melanogaster sequenced genome of 139.5 million base pairs has been annotated[77] and contains around 15,682 genes according to Ensemble release 73. More than 60% of the genome appears to be functional non-protein-coding DNA[78] involved in gene expression control. Determination of sex in Drosophila occurs by the X:A ratio of X chromosomes to autosomes, not because of the presence of a Y chromosome as in human sex determination. Although the Y chromosome is entirely heterochromatic, it contains at least 16 genes, many of which are thought to have male-related functions.[79]
There are three transferrin orthologs, all of which are dramatically divergent from those known in chordate models.[80]
A March 2000 study by National Human Genome Research Institute comparing the fruit fly and human genome estimated that about 60% of genes are conserved between the two species.[81] About 75% of known human disease genes have a recognizable match in the genome of fruit flies,[82] and 50% of fly protein sequences have mammalian homologs. An online database called Homophila is available to search for human disease gene homologues in flies and vice versa.[83]
Drosophila is being used as a genetic model for several human diseases including the neurodegenerative disorders Parkinson's, Huntington's, spinocerebellar ataxia and Alzheimer's disease.[84] The fly is also being used to study mechanisms underlying aging and oxidative stress, immunity, diabetes, and cancer, as well as drug abuse.[85][86][87]
Drosophila is one of the few animals (C. elegans being another) where detailed neural circuits (a connectome) are available.
A high-level connectome, at the level of brain compartments and interconnecting tracts of neurons, exists for the full fly brain.[88] A version of this is available online.[89]
Detailed circuit-level connectomes exist for the lamina[90][91] and a medulla[92] column, both in the visual system of the fruit fly, and the alpha lobe of the mushroom body.[93]
In May 2017 a paper published in bioRxiv presented an electron microscopy image stack of the whole adult female brain at synaptic resolution. The volume is available for sparse tracing of selected circuits.[94][95] Since then, multiple datasets have been collected including a dense connectome of half the central brain of Drosophila in 2020,[96][97] and a dense connectome of the entire female adult nerve cord in 2021.[98] Generally, these datasets are acquired by sectioning the tissue (e.g. the brain) into thin sections (on order of ten or hundreds of nanometers). Each section is then imaged using an electron microscope and these images are stitched and aligned together to create a 3D image volume. The methods used in reconstruction and initial analysis of the such datasets followed.[99] Due to advancements in deep learning, automated methods for image segmentation have made large scale reconstruction providing dense reconstructions of all the neurites within the volume.[100] Furthermore, the resolution of electron microscopy illuminates ultrastructural variations between neurons as well as the location of individual synapses, thereby providing a wiring diagram of synaptic connectivity between all neurites within the given dataset.
In 2023, the complete map of a Drosophila larval brain at the synapse level, and an analysis of its architecture was published. The larval brain consists of 3016 neurons and 548,000 synapses,[101] whereas the adult brain has about 150,000 neurons and 150 million synapses.
The life cycle of this insect has four stages: fertilized egg, larva, pupa, and adult.[11]
Embryogenesis in Drosophila has been extensively studied, as its small size, short generation time, and large brood size makes it ideal for genetic studies. It is also unique among model organisms in that cleavage occurs in a syncytium.

During oogenesis, cytoplasmic bridges called "ring canals" connect the forming oocyte to nurse cells. Nutrients and developmental control molecules move from the nurse cells into the oocyte. In the figure to the left, the forming oocyte can be seen to be covered by follicular support cells.
After fertilization of the oocyte, the early embryo (or syncytial embryo) undergoes rapid DNA replication and 13 nuclear divisions until about 5000 to 6000 nuclei accumulate in the unseparated cytoplasm of the embryo. By the end of the eighth division, most nuclei have migrated to the surface, surrounding the yolk sac (leaving behind only a few nuclei, which will become the yolk nuclei). After the 10th division, the pole cells form at the posterior end of the embryo, segregating the germ line from the syncytium. Finally, after the 13th division, cell membranes slowly invaginate, dividing the syncytium into individual somatic cells. Once this process is completed, gastrulation starts.[102]
Nuclear division in the early Drosophila embryo happens so quickly, no proper checkpoints exist, so mistakes may be made in division of the DNA. To get around this problem, the nuclei that have made a mistake detach from their centrosomes and fall into the centre of the embryo (yolk sac), which will not form part of the fly.
The gene network (transcriptional and protein interactions) governing the early development of the fruit fly embryo is one of the best understood gene networks to date, especially the patterning along the anteroposterior (AP) and dorsoventral (DV) axes (See under morphogenesis).[102]
The embryo undergoes well-characterized morphogenetic movements during gastrulation and early development, including germ-band extension, formation of several furrows, ventral invagination of the mesoderm, and posterior and anterior invagination of endoderm (gut), as well as extensive body segmentation until finally hatching from the surrounding cuticle into a first-instar larva.
During larval development, tissues known as imaginal discs grow inside the larva. Imaginal discs develop to form most structures of the adult body, such as the head, legs, wings, thorax, and genitalia. Cells of the imaginal disks are set aside during embryogenesis and continue to grow and divide during the larval stages—unlike most other cells of the larva, which have differentiated to perform specialized functions and grow without further cell division. At metamorphosis, the larva forms a pupa, inside which the larval tissues are reabsorbed and the imaginal tissues undergo extensive morphogenetic movements to form adult structures.
Biotic and abiotic factors experienced during development will affect developmental resource allocation leading to phenotypic variation, also referred to as developmental plasticity.[103][104] As in all insects,[104] environmental factors can influence several aspects of development in Drosophila melanogaster.[105][106] Fruit flies reared under a hypoxia treatment experience decreased thorax length, while hyperoxia produces smaller flight muscles, suggesting negative developmental effects of extreme oxygen levels.[107] Circadian rhythms are also subject to developmental plasticity. Light conditions during development affect daily activity patterns in Drosophila melanogaster, where flies raised under constant dark or light are less active as adults than those raised under a 12-hour light/dark cycle.[108]
Temperature is one of the most pervasive factors influencing arthropod development. In Drosophila melanogaster temperature-induced developmental plasticity can be beneficial and/or detrimental.[109][110] Most often lower developmental temperatures reduce growth rates which influence many other physiological factors.[111] For example, development at 25 °C increases walking speed, thermal performance breadth, and territorial success, while development at 18 °C increases body mass, wing size, all of which are tied to fitness.[106][109] Moreover, developing at certain low temperatures produces proportionally large wings which improve flight and reproductive performance at similarly low temperatures (See acclimation).[112]
While certain effects of developmental temperature, like body size, are irreversible in ectotherms, others can be reversible.[104][113] When Drosophila melanogaster develop at cold temperatures they will have greater cold tolerance, but if cold-reared flies are maintained at warmer temperatures their cold tolerance decreases and heat tolerance increases over time.[113][114] Because insects typically only mate in a specific range of temperatures, their cold/heat tolerance is an important trait in maximizing reproductive output.[115]
While the traits described above are expected to manifest similarly across sexes, developmental temperature can also produce sex-specific effects in D. melanogaster adults.
Drosophila flies have both X and Y chromosomes, as well as autosomes. Unlike humans, the Y chromosome does not confer maleness; rather, it encodes genes necessary for making sperm. Sex is instead determined by the ratio of X chromosomes to autosomes.[120] Furthermore, each cell "decides" whether to be male or female independently of the rest of the organism, resulting in the occasional occurrence of gynandromorphs.
Three major genes are involved in determination of Drosophila sex. These are sex-lethal, sisterless, and deadpan. Deadpan is an autosomal gene which inhibits sex-lethal, while sisterless is carried on the X chromosome and inhibits the action of deadpan. An AAX cell has twice as much deadpan as sisterless, so sex-lethal will be inhibited, creating a male. However, an AAXX cell will produce enough sisterless to inhibit the action of deadpan, allowing the sex-lethal gene to be transcribed to create a female.
Later, control by deadpan and sisterless disappears and what becomes important is the form of the sex-lethal gene. A secondary promoter causes transcription in both males and females. Analysis of the cDNA has shown that different forms are expressed in males and females. Sex-lethal has been shown to affect the splicing of its own mRNA. In males, the third exon is included which encodes a stop codon, causing a truncated form to be produced. In the female version, the presence of sex-lethal causes this exon to be missed out; the other seven amino acids are produced as a full peptide chain, again giving a difference between males and females.[121]
Presence or absence of functional sex-lethal proteins now go on to affect the transcription of another protein known as doublesex. In the absence of sex-lethal, doublesex will have the fourth exon removed and be translated up to and including exon 6 (DSX-M[ale]), while in its presence the fourth exon which encodes a stop codon will produce a truncated version of the protein (DSX-F[emale]). DSX-F causes transcription of Yolk proteins 1 and 2 in somatic cells, which will be pumped into the oocyte on its production.
The D. melanogaster immune system can be divided into two responses: humoral and cell-mediated. The former is a systemic response mediated in large part through the toll and Imd pathways, which are parallel systems for detecting microbes. Other pathways including the stress response pathways JAK-STAT and P38, nutritional signalling via FOXO, and JNK cell death signalling are all involved in key physiological responses to infection. D. melanogaster has an organ called the "fat body", which is analogous to the human liver. The fat body is the primary secretory organ and produces key immune molecules upon infection, such as serine proteases and antimicrobial peptides (AMPs). AMPs are secreted into the hemolymph and bind infectious bacteria and fungi, killing them by forming pores in their cell walls or inhibiting intracellular processes. The cellular immune response instead refers to the direct activity of blood cells (hemocytes) in Drosophila, which are analogous to mammalian monocytes/macrophages. Hemocytes also possess a significant role in mediating humoral immune responses such as the melanization reaction.[122]
The immune response to infection can involve up to 2,423 genes, or 13.7% of the genome. Although the fly's transcriptional response to microbial challenge is highly specific to individual pathogens, Drosophila differentially expresses a core group of 252 genes upon infection with most bacteria. This core group of genes is associated with gene ontology categories such as antimicrobial response, stress response, secretion, neuron-like, reproduction, and metabolism among others.[123][124] Drosophila also possesses several immune mechanisms to both shape the microbiota and prevent excessive immune responses upon detection of microbial stimuli. For instance, secreted PGRPs with amidase activity scavenge and degrade immunostimulatory DAP-type PGN in order to block Imd activation.[125]
Unlike mammals, Drosophila have innate immunity but lack an adaptive immune response. However, the core elements of this innate immune response are conserved between humans and fruit flies. As a result, the fruit fly offers a useful model of innate immunity for disentangling genetic interactions of signalling and effector function, as flies do not have to contend with interference of adaptive immune mechanisms that could confuse results. Various genetic tools, protocols, and assays make Drosophila a classical model for studying the innate immune system,[126] which has even included immune research on the international space station.[127]
The first description of toll-like receptors involved in the response to infection was performed in Drosophila, culminating in a Nobel prize in 2011.[131][132] The toll pathway in Drosophila is homologous to toll-like pathways in mammals. This regulatory cascade is initiated following pathogen recognition by pattern recognition receptors, particularly of Gram-positive bacteria, parasites, and fungal infection. This activation leads to serine protease signalling cascades ultimately activating the cytokine spätzle. Alternatively, microbial proteases can directly cleave serine proteases like Persephone that then propagate signalling.[133] The cytokine spätzle then acts as the ligand for the toll pathway in flies. Upon infection, pro-spätzle is cleaved by the protease SPE (spätzle-processing enzyme) to become active spätzle, which binds to the toll receptor located on the cell surface of the fat body and dimerizes for activation of downstream NF-κB signaling pathways, including multiple death domain containing proteins and negative regulators such as the ankyrin repeat protein Cactus. The pathway culminates with the translocation of the NF-κB transcription factors Dorsal and Dif (Dorsal-related immunity factor) into the nucleus.[134] Dudzic et al.[135] find a large number of shared serine protease messengers and crosstalk between this pathway and immunity-related melanization pathways.[136][137]
The toll pathway was identified by its regulation of antimicrobial peptides (AMPs), including the antifungal peptide drosomycin. Upon infection, AMPs increase in expression sometimes by 1,000-fold, providing unmistakable readouts of pathway activation. Another group of toll-regulated AMP-like effectors includes the Bomanins, which appear to be responsible for the bulk of toll-mediated immune defence.[138] However Bomanins alone do not exhibit antimicrobial activity.[139]
It has been proposed that a second SPE-like enzyme similarly acts to activate spätzle, as loss of SPE does not completely reduce the activity of toll signalling,[140] however no second SPE has yet been identified. A number of serine proteases are yet to be characterized, including many with homology to SPE.[129] The toll pathway also interacts with renal filtration of microbiota-derived peptidoglycan, maintaining immune homeostasis. Mechanistically, nephrocytes endocytose Lys-type PGN from systemic circulation and route it to lysosomes for degradation. Without this, toll signalling is constitutively activated, resulting in a severe drain on nutrient reserves and a significant stress on host physiology.[141]
The Imd pathway is orthologous to human TNF receptor superfamily signalling, and is triggered by Gram-negative bacteria through recognition by peptidoglycan recognition proteins (PGRP) including both soluble receptors and cell surface receptors (PGRP-LE and LC, respectively). Imd signalling culminates in the translocation of the NF-κB transcription factor Relish into the nucleus, leading to the upregulation of Imd-responsive genes including the AMP Diptericin. Consequently, flies deficient for AMPs resemble Imd pathway mutants in terms of susceptibility to bacterial infection.[142] Imd signalling and Relish specifically are also involved in the regulation of immunity at surface epithelia including in the gut and respiratory tracts.[122]
The Relish transcription factor has also been implicated in processes regarding cell proliferation[143] and neurodegeneration either through autophagy,[144] or autoimmune toxicity.[145][146] In neurodegenerative models relying on Imd signalling, expression of AMPs in the brain is correlated with brain tissue damage, lesions, and ultimately death.[147][148][149] Relish-regulated AMPs such as Defensin and Diptericin also have anti-cancer properties promoting tumour clearance.[150][151] The Imd-regulated AMP Diptericin B is also produced by the fat body specifically in the head, and Diptericin B is required for long-term memory formation.[152]
Multiple elements of the Drosophila JAK-STAT signalling pathway bear direct homology to human JAK-STAT pathway genes. JAK-STAT signalling is induced upon various organismal stresses such as heat stress, dehydration, or infection. JAK-STAT induction leads to the production of a number of stress response proteins including Thioester-containing proteins (TEPs),[153] Turandots,[154] and the putative antimicrobial peptide Listericin.[155] The mechanisms through which many of these proteins act is still under investigation. For instance, the TEPs appear to promote phagocytosis of Gram-positive bacteria and the induction of the toll pathway. As a consequence, flies lacking TEPs are susceptible to infection by toll pathway challenges.[153]
Circulating hemocytes are key regulators of infection. This has been demonstrated both through genetic tools to generate flies lacking hemocytes, or through injecting microglass beads or lipid droplets that saturate hemocyte ability to phagocytose a secondary infection.[156][157] Flies treated like this fail to phagocytose bacteria upon infection, and are correspondingly susceptible to infection.[158] These hemocytes derive from two waves of hematopoiesis, one occurring in the early embryo and one occurring during development from larva to adult.[159] However Drosophila hemocytes do not renew over the adult lifespan, and so the fly has a finite number of hemocytes that decrease over the course of its lifespan.[160] Hemocytes are also involved in regulating cell-cycle events and apoptosis of aberrant tissue (e.g. cancerous cells) by producing Eiger, a tumor necrosis factor signalling molecule that promotes JNK signalling and ultimately cell death and apoptosis.[161]
In 1971, Ron Konopka and Seymour Benzer published "Clock mutants of Drosophila melanogaster", a paper describing the first mutations that affected an animal's behavior. Wild-type flies show an activity rhythm with a frequency of about a day (24 hours). They found mutants with faster and slower rhythms, as well as broken rhythms—flies that move and rest in random spurts. Work over the following 30 years has shown that these mutations (and others like them) affect a group of genes and their products that form a biochemical or biological clock. This clock is found in a wide range of fly cells, but the clock-bearing cells that control activity are several dozen neurons in the fly's central brain.
Since then, Benzer and others have used behavioral screens to isolate genes involved in vision, olfaction, audition, learning/memory, courtship, pain, and other processes, such as longevity.
Following the pioneering work of Alfred Henry Sturtevant[162] and others, Benzer and colleagues[43] used sexual mosaics to develop a novel fate mapping technique. This technique made it possible to assign a particular characteristic to a specific anatomical location. For example, this technique showed that male courtship behavior is controlled by the brain.[43] Mosaic fate mapping also provided the first indication of the existence of pheromones in this species.[163] Males distinguish between conspecific males and females and direct persistent courtship preferentially toward females thanks to a female-specific sex pheromone which is mostly produced by the female's tergites.
The first learning and memory mutants (dunce, rutabaga, etc.) were isolated by William "Chip" Quinn while in Benzer's lab, and were eventually shown to encode components of an intracellular signaling pathway involving cyclic AMP, protein kinase A, and a transcription factor known as CREB. These molecules were shown to be also involved in synaptic plasticity in Aplysia and mammals.[164]
The Nobel Prize in Physiology or Medicine for 2017 was awarded to Jeffrey C. Hall, Michael Rosbash, Michael W. Young for their works using fruit flies in understanding the "molecular mechanisms controlling the circadian rhythm".[165]
Male flies sing to the females during courtship using their wings to generate sound, and some of the genetics of sexual behavior have been characterized. In particular, the fruitless gene has several different splice forms, and male flies expressing female splice forms have female-like behavior and vice versa. The TRP channels nompC, nanchung, and inactive are expressed in sound-sensitive Johnston's organ neurons and participate in the transduction of sound.[166][167] Mutating the Genderblind gene, also known as CG6070, alters the sexual behavior of Drosophila, turning the flies bisexual.[168]
Flies use a modified version of Bloom filters to detect novelty of odors, with additional features including similarity of novel odor to that of previously experienced examples, and time elapsed since previous experience of the same odor.[169]
As with most insects, aggressive behaviors between male flies commonly occur in the presence of courting a female and when competing for resources. Such behaviors often involve raising wings and legs towards the opponent and attacking with the whole body.[170] Thus, it often causes wing damage, which reduces their fitness by removing their ability to fly and mate.[171]
In order for aggression to occur, male flies produce sounds to communicate their intent. A 2017 study found that songs promoting aggression contain pulses occurring at longer intervals.[172] RNA sequencing from fly mutants displaying over-aggressive behaviors found more than 50 auditory-related genes (important for transient receptor potentials, Ca2+ signaling, and mechanoreceptor potentials) to be upregulated in the AB neurons located in Johnston's organ.[172] In addition, aggression levels were reduced when these genes were knocked out via RNA interference.[172] This signifies the major role of hearing as a sensory modality in communicating aggression.
Other than hearing, another sensory modality that regulates aggression is pheromone signaling, which operates through either the olfactory system or the gustatory system depending on the pheromone.[173] An example is cVA, an anti-aphrodisiac pheromone used by males to mark females after copulation and to deter other males from mating.[174] This male-specific pheromone causes an increase in male-male aggression when detected by another male's gustatory system.[173] However, upon inserting a mutation that makes the flies irresponsive to cVA, no aggressive behaviors were seen.[175] This shows how there are multiple modalities for promoting aggression in flies.
Specifically, when competing for food, aggression occurs based on amount of food available and is independent of any social interactions between males.[176] Specifically, sucrose was found to stimulate gustatory receptor neurons, which was necessary to stimulate aggression.[176] However, once the amount of food becomes greater than a certain amount, the competition between males lowers.[176] This is possibly due to an over-abundance of food resources. On a larger scale, food was found to determine the boundaries of a territory since flies were observed to be more aggressive at the food's physical perimeter.
However, like most behaviors requiring arousal and wakefulness, aggression was found to be impaired via sleep deprivation. Specifically, this occurs through the impairment of Octopamine and dopamine signaling, which are important pathways for regulating arousal in insects.[177][178] Due to reduced aggression, sleep-deprived male flies were found to be disadvantaged at mating compared to normal flies.[178] However, when octopamine agonists were administered upon these sleep-deprived flies, aggression levels were seen to be increased and sexual fitness was subsequently restored.[178] Therefore, this finding implicates the importance of sleep in aggression between male flies.
It is now relatively simple to generate transgenic flies in Drosophila, relying on a variety of techniques. One approach of inserting foreign genes into the Drosophila genome involves P elements. The transposable P elements, also known as transposons, are segments of bacterial DNA that are transferred into the fly genome. Transgenic flies have already contributed to many scientific advances, e.g., modeling such human diseases as Parkinson's, neoplasia, obesity, and diabetes.[179]
The compound eye of the fruit fly contains 760 unit eyes or ommatidia, and are one of the most advanced among insects. Each ommatidium contains eight photoreceptor cells (R1-8), support cells, pigment cells, and a cornea. Wild-type flies have reddish pigment cells, which serve to absorb excess blue light so the fly is not blinded by ambient light. Eye color genes regulate cellular vesicular transport. The enzymes needed for pigment synthesis are then transported to the cell's pigment granule, which holds pigment precursor molecules.[63]
Each photoreceptor cell consists of two main sections, the cell body and the rhabdomere. The cell body contains the nucleus, while the 100-μm-long rhabdomere is made up of toothbrush-like stacks of membrane called microvilli. Each microvillus is 1–2 μm in length and about 60 nm in diameter.[180] The membrane of the rhabdomere is packed with about 100 million opsin molecules, the visual protein that absorbs light. The other visual proteins are also tightly packed into the microvilli, leaving little room for cytoplasm.
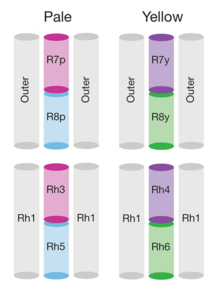
The genome of Drosophila encodes seven opsins,[182] five of those are expressed in the omatidia of the eye. The photoreceptor cells R1-R6 express the opsin Rh1,[183] which absorbs maximally blue light (around 480 nm),[184][185][186] however the R1-R6 cells cover a broader range of the spectrum than an opsin would allow due to a sensitising pigment[187][188] that adds two sensitivity maxima in the UV-range (355 and 370 nm).[186] The R7 cells come in two types with yellow and pale rhabdomeres (R7y and R7p).[189][190] The pale R7p cells express the opsin Rh3,[191][192] which maximally absorbs UV-light (345 nm).[193] The R7p cells are strictly paired with the R8p cells that express Rh5,[192] which maximally absorbs violet light (437 nm).[186] The other, the yellow R7y cells express a blue-absorbing screening pigment[189] and the opsin Rh4,[194] which maximally absorbs UV-light (375 nm).[193] The R7y cells are strictly paired with R8y cells that express Rh6,[195] which maximally absorbs UV-light (508 nm).[186] In a subset of omatidia both R7 and R8 cells express the opsin Rh3.[192]
However, these absorption maxima of the opsins where measured in white eyed flies without screening pigments (Rh3-Rh6),[193][186] or from the isolated opsin directly (Rh1).[184] Those pigments reduce the light that reaches the opsins depending on the wavelength. Thus in fully pigmented flies, the effective absorption maxima of opsins differs and thus also the sensitivity of their photoreceptor cells. With screening pigment, the opsin Rh3 is short wave shifted from 345 nm[b] to 330 nm and Rh4 from 375 nm to 355 nm. Whether screening pigment is present does not make a practical difference for the opsin Rh5 (435 nm and 437 nm), while the opsin R6 is long wave shifted by 92 nm from 508 nm to 600 nm.[181]
Additionally of the opsins of the eye, Drosophila has two more opsins: The ocelli express the opsin Rh2,[196][197] which maximally absorbs violet light (~420 nm).[197] And the opsin Rh7, which maximally absorbs UV-light (350 nm) with an unusually long wavelength tail up to 500 nm. The long tail disappears if a lysine at position 90 is replaced by glutamic acid. This mutant then absorbs maximally violet light (450 nm).[198] The opsin Rh7 entrains with cryptochrome the circadian rhythm of Drosophila to the day-night-cycle in the central pacemaker neurons.[199]
Each Drosophila opsin binds the carotenoid chromophore 11-cis-3-hydroxyretinal via a lysine.[200][201] This lysine is conserved in almost all opsins, only a few opsins have lost it during evolution.[202] Opsins without it are not light sensitive.[203][204][205] In particular, the Drosophila opsins Rh1, Rh4, and Rh7 function not only as photoreceptors, but also as chemoreceptors for aristolochic acid. These opsins still have the lysine like other opsins. However, if it is replaced by an arginine in Rh1, then Rh1 loses light sensitivity but still responds to aristolochic acid. Thus, the lysine is not needed for Rh1 to function as chemoreceptor.[204]
Spectral sensitivities of Drosophila melanogaster opsins in white eyed flies. The sensitivities of Rh3–R6 are modelled with opsin templates and sensitivity estimates from Salcedo et al. (1999).[186] The opsin Rh1 (redrawn from Salcedo et al.[186]) has a characteristic shape as it is coupled to a UV-sensitising pigment.
As in vertebrate vision, visual transduction in invertebrates occurs via a G protein-coupled pathway. However, in vertebrates, the G protein is transducin, while the G protein in invertebrates is Gq (dgq in Drosophila). When rhodopsin (Rh) absorbs a photon of light its chromophore, 11-cis-3-hydroxyretinal, is isomerized to all-trans-3-hydroxyretinal. Rh undergoes a conformational change into its active form, metarhodopsin. Metarhodopsin activates Gq, which in turn activates a phospholipase Cβ (PLCβ) known as NorpA.[206]
PLCβ hydrolyzes phosphatidylinositol (4,5)-bisphosphate (PIP2), a phospholipid found in the cell membrane, into soluble inositol triphosphate (IP3) and diacylglycerol (DAG), which stays in the cell membrane. DAG, a derivative of DAG, or PIP2 depletion cause a calcium-selective ion channel known as transient receptor potential (TRP) to open and calcium and sodium flows into the cell.[207] IP3 is thought to bind to IP3 receptors in the subrhabdomeric cisternae, an extension of the endoplasmic reticulum, and cause release of calcium, but this process does not seem to be essential for normal vision.[206]
Calcium binds to proteins such as calmodulin (CaM) and an eye-specific protein kinase C (PKC) known as InaC. These proteins interact with other proteins and have been shown to be necessary for shut off of the light response. In addition, proteins called arrestins bind metarhodopsin and prevent it from activating more Gq. A sodium-calcium exchanger known as CalX pumps the calcium out of the cell. It uses the inward sodium gradient to export calcium at a stoichiometry of 3 Na+/ 1 Ca++.[208]
TRP, InaC, and PLC form a signaling complex by binding a scaffolding protein called InaD. InaD contains five binding domains called PDZ domain proteins, which specifically bind the C termini of target proteins. Disruption of the complex by mutations in either the PDZ domains or the target proteins reduces the efficiency of signaling. For example, disruption of the interaction between InaC, the protein kinase C, and InaD results in a delay in inactivation of the light response.
Unlike vertebrate metarhodopsin, invertebrate metarhodopsin can be converted back into rhodopsin by absorbing a photon of orange light (580 nm).
About two-thirds of the Drosophila brain is dedicated to visual processing.[209] Although the spatial resolution of their vision is significantly worse than that of humans, their temporal resolution is around 10 times better.
Drosophila are known to exhibit grooming behaviors that are executed in a predictable manner. Drosophila consistently begin a grooming sequence by using their front legs to clean the eyes, then the head and antennae. Using their hind legs, Drosophila proceed to groom their abdomen, and finally the wings and thorax. Throughout this sequence, Drosophila periodically rub their legs together to get rid of excess dust and debris that accumulates during the grooming process.[210]
Grooming behaviors have been shown to be executed in a suppression hierarchy. This means that grooming behaviors that occur at the beginning of the sequence prevent those that come later in the sequence from occurring simultaneously, as the grooming sequence consists of mutually exclusive behaviors.[211][212] This hierarchy does not prevent Drosophila from returning to grooming behaviors that have already been accessed in the grooming sequence.[211] The order of grooming behaviors in the suppression hierarchy is thought to be related to the priority of cleaning a specific body part. For example, the eyes and antennae are likely executed early on in the grooming sequence to prevent debris from interfering with the function of D. melanogaster's sensory organs.[211][212]

Like many other hexapod insects, Drosophila typically walk using a tripod gait.[214] This means that three of the legs swing together while the other three remain stationary, or in stance. Variability around the tripod configuration appears to be continuous, meaning that flies do not exhibit distinct transitions between different gaits.[215] At fast walking speeds (15–30 mm/s), the walking configuration is mostly tripod (3 legs in stance), but at low walking speeds (0–15 mm/s), flies are more likely to have four or five legs in stance.[216][217] These transitions may help to optimize static stability.[218] Because flies are so small, inertial forces are negligible compared with the elastic forces of their muscles and joints or the viscous forces of the surrounding air.[219]
In addition to stability, the robustness of a walking gait is also thought to be important in determining the gait of a fly at a particular walking speed. Robustness refers to how much offset in the timing of a legs stance can be tolerated before the fly becomes statically unstable.[218] For instance, a robust gait may be particularly important when traversing uneven terrain, as it may cause unexpected disruptions in leg coordination. Using a robust gait would help the fly maintain stability in this case. Analyses suggest that Drosophila may exhibit a compromise between the most stable and most robust gait at a given walking speed.[218]
Flies fly via straight sequences of movement interspersed by rapid turns called saccades.[220] During these turns, a fly is able to rotate 90° in less than 50 milliseconds.[220]
Characteristics of Drosophila flight may be dominated by the viscosity of the air, rather than the inertia of the fly body, but the opposite case with inertia as the dominant force may occur.[220] However, subsequent work showed that while the viscous effects on the insect body during flight may be negligible, the aerodynamic forces on the wings themselves actually cause fruit flies' turns to be damped viscously.[221]
Drosophila is sometimes referred to as a pest due to its tendency to live in human settlements, where fermenting fruit is found. Flies may collect in homes, restaurants, stores, and other locations.[12] The name and behavior of this species of fly has led to the misconception that it is a biological security risk in Australia. While other "fruit fly" species do pose a risk, D. melanogaster is attracted to fruit that is already rotting, rather than causing fruit to rot.[222][223]
Drosophila melanogaster is a species of fly (the taxonomic order Diptera) in the family Drosophilidae. The species is often referred to as the fruit fly or lesser fruit fly, or less commonly the "vinegar fly" or "pomace fly". Starting with Charles W. Woodworth's 1901 proposal of the use of this species as a model organism, D. melanogaster continues to be widely used for biological research in genetics, physiology, microbial pathogenesis, and life history evolution. As of 2017, five Nobel Prizes have been awarded to drosophilists for their work using the insect.
D. melanogaster is typically used in research owing to its rapid life cycle, relatively simple genetics with only four pairs of chromosomes, and large number of offspring per generation. It was originally an African species, with all non-African lineages having a common origin. Its geographic range includes all continents, including islands. D. melanogaster is a common pest in homes, restaurants, and other places where food is served.
Flies belonging to the family Tephritidae are also called "fruit flies". This can cause confusion, especially in the Mediterranean, Australia, and South Africa, where the Mediterranean fruit fly Ceratitis capitata is an economic pest.
Drosophila melanogaster (en griego significa literalmente «amante del rocío de vientre negro»), también llamada mosca del vinagre o mosca de la fruta, es una especie de díptero braquícero de la familia Drosophilidae. Recibe su nombre debido a que se alimenta de frutas en proceso de fermentación tales como manzanas, bananas, uvas, etc. Es una especie utilizada frecuentemente en experimentación genética, dado que posee un reducido número de cromosomas (4 pares), breve ciclo de vida (15-21 días) y aproximadamente el 61 % de los genes de enfermedades humanas que se conocen tienen una contrapartida identificable en el genoma de las moscas de la fruta, y el 50 % de las secuencias proteínicas de la mosca tiene análogos en los mamíferos.[2]
Para propósitos de investigación, fácilmente pueden reemplazar a los humanos. Se reproducen rápidamente, de modo que se pueden estudiar muchas generaciones en un corto espacio de tiempo, y ya se conoce el mapa completo de su genoma. Fue adoptada como animal de experimentación genética por Thomas Morgan a principios del siglo XX. Sus 165 Mb de genoma (1 Mb = 1 millón de pares de bases) fueron publicados en marzo de 2000 gracias al consorcio público y la compañía Celera Genomics.[3] Alberga alrededor de 13.600 genes.
De una célula derivan células hijas que generan una posible asimetría. Presenta una asimetría inicial en la distribución de sus componentes citoplasmáticos que da lugar a sus diferencias de desarrollo. En la ovogénesis se generan células foliculares, células nodrizas y el ovocito. La mosca de la fruta, a 29 °C, alcanza a vivir 30 días; y el desarrollo de huevo a adulto demanda 7 días.[4][5][6][4][5][7]
El El primordio desarrolla diferencias en los ejes: anteroposterior y dorsoventral.
Una sucesión de acontecimientos derivados de la asimetría inicial del cigoto se traduce en el control de la expresión génica de forma que las regiones diferentes del huevo adquieren distintas propiedades. Esto puede ocurrir por la diferente localización de los factores de transcripción y traducción en el huevo o por el control diferencial de las actividades de estos factores.
Después sigue otra etapa en la que se determinan las identidades de las partes del embrión: se definen regiones de las que derivan partes concretas del cuerpo.
Los genes que regulan el proceso codifican reguladores de la transcripción y actúan unos sobre otros de forma jerárquica. También actúan sobre otros genes que son los que verdaderamente se encargan del establecimiento de este patrón (actúan en cascada).
También hay que tener en cuenta las interacciones célula-célula ya que definen las fronteras entre los grupos celulares.
Hay 3 grupos de genes en función de sus efectos sobre la estructura de un segmento:
La siguiente etapa del desarrollo depende de los genes que se expresan en la mosca madre. Estos genes se expresan antes de la fertilización. Pueden dividirse en:
Existen cuatro grupos de genes que intervienen en el desarrollo de las diferentes partes del embrión. Cada grupo se organiza en una vía diferente que presenta un orden concreto de actuación. Cada vía se inicia con hechos que tiene lugar fuera del huevo, lo que tiene como resultado la localización de una señal dentro de este. Estas señales (son proteínas que reciben el nombre de morfógenos) se distribuyen de forma asimétrica para cumplir funciones diferentes.
Del eje antero-posterior se encargan 3 sistemas y del dorso-ventral se encarga uno:
Todos los componentes de los cuatro sistemas son maternos por lo que los sistemas que establecen el patrón inicial dependen de sucesos anteriores a la fertilización.
Existe una compleja interrelación entre oocito y células foliculares (genes del oocito son necesarios para el desarrollo de células foliculares y señales de estas, transmitidas al oocito, provocan el desarrollo de estructuras ventrales).
Otra vía se encarga del desarrollo dorsal durante el crecimiento del huevo.
Los sistemas funcionan por la activación de una interacción ligando-receptor que desencadena una vía de transducción.
El proceso depende, en su inicio, del gen Gurken (que actúa también en diferenciación antero-posterior). El mRNA de Gurken se sitúa en la cara posterior del oocito haciendo que las células foliculares adyacentes se diferencien en células posteriores. Estas células devuelven una señal que desencadena la producción de una red de microtúbulos que es necesaria para la polaridad.
La polaridad dorsoventral se establece cuando gurken llega a la cara dorsal del oocito (depende de la expresión de varios genes más).
El producto de Gurken actúa como ligando interaccionando con el receptor (producto del gen Torpedo) de una célula folicular.
La activación de este receptor desencadena una vía de señalización cuyo efecto final es el impedimento a que se desarrolle la cara ventral en la dorsal (se produce un cambio en las propiedades de las células foliculares de esta cara).
El desarrollo de estructuras ventrales requiere genes maternos que establecen el eje dorso-ventral. El sistema dorsal es necesario para el desarrollo de estructuras ventrales (como mesodermo y neuroectodermo). Mutaciones en él, impiden el desarrollo ventral.
La vía del desarrollo ventral, también se inicia en las células foliculares y finaliza en el oocito. En las células foliculares se producen una serie de señales que acaban generando un ligando par el receptor (producto del gen Toll = primer componente de la vía, que actúa dentro del oocito).
Toll es el gen crucial en el transporte de la señal al interior del oocito.
El resto de componentes del grupo dorsal codifican productos que o regulan o son necesarios para la acción de Toll. Toll es una proteína transmembrana (homóloga al receptor de la interleuquina 1).
La unión de su ligando al receptor Toll, activa la vía que determina el desarrollo ventral. La distribución del producto de este gen es muy variable, pero solo induce la formación de estructuras ventrales en lugares adecuados (parece que solo se expresa producto activo en ciertas regiones).
Tras la unión del ligando, el receptor Toll se activa en la cara ventral del embrión. Esta activación desencadena en una serie de procesos en los que intervienen los productos de otros genes y que termina en la fosforilación del producto del gen cactus que es el regulador final del factor de transcripción del gen Dorsal.
En el citoplasma hay un complejo cactus-dorsal inactivo pero que al fosforilarse cactus libera a la proteína dorsal, que entra en el núcleo.
La activación de toll lleva a la activación de dorsal.
Se establece un gradiente de proteína dorsal en el núcleo que va del lado dorsal al ventral en el embrión. En la cara ventral, la proteína dorsal se libera hacia el núcleo pero en la dorsal, permanece en el citoplasma.
La proteína dorsal activa a los genes Twist y Snail (necesarios para el desarrollo de estructuras ventrales) e inhibe a los genes Decapentaplegic y Zerknullt (necesarios para el desarrollo de estructuras dorsales). La interacción inicial entre gurken y torpedo lleva a la represión de la actividad de spatzle en la cara dorsal del embrión (ligando de toll).
La proteína dorsal, situada en el núcleo, inhibe la expresión de dpp. De este modo, las estructuras ventrales se forman según un gradiente nuclear de la proteína dorsal y las estructuras dorsales según un gradiente de la proteína dpp.
D. melanogaster fue uno de los primeros organismos utilizados para el análisis genético, y en la actualidad es uno de los organismos eucarióticos más ampliamente utilizados y genéticamente más conocidos.[8]
Thomas Hunt Morgan comenzó a usar esta especie en la Universidad de Columbia en 1910 en un laboratorio conocido como "la sala de moscas". Él y sus colaboradores (incluso los famosos genetistas A.H. Sturtevant, Calvin Bridges, y H. J. Muller), comenzaron experimentos utilizando botellas de leche para criar moscas y lupas para observarlas. Las lupas fueron reemplazadas más tarde por microscopios de disección. Gracias a estas moscas pequeñas e inofensivas, Morgan y sus colaboradores dilucidaron muchos principios básicos de herencia, incluso la herencia ligada al sexo, epistasis, alelos múltiples y mapeo de genes.
Dentro del análisis genético, se realizaron estudios de pérdida de función, que implicaban el silenciamiento de diversos genes para observar cual era la función que llevaban a cabo. De esta forma, el genoma de la mosca de la fruta fue alterado, en primer lugar, mediante el uso de mutágenos que ocasionaban cambios en su secuencia de ADN sin un estricto control experimental, como elementos genéticos transponibles, rayos X o químicos mutagénicos. Más adelante, se procedió al empleo de ARN interferente (RNAi) que, junto al sistema GAL4-UAS, permite la edición en un tejido determinado específicamente. En último lugar, y más recientemente, su genoma es estudiado mediante el uso del sistema CRISPR junto con la nucleasa Cas9, permitiendo una edición más sencilla, efectiva y asequible. Gracias a este descubrimiento, se ha procedido al desarrollo de nuevas nucleasas con funciones complementarias a Cas9 que permitan profundizar en la edición y estudio de este organismo mediante este sistema, como la nucleasa Cas12a (anteriormente conocida como Cpf1), y la nucleasa CasΦ.[9]
Seymour Benzer y otros han utilizado mutaciones que afectan el comportamiento de estas moscas para aislar genes implicados en la visión, el olfato, la audición, el aprendizaje, la memoria, el cortejo, el dolor, y otros procesos.
Tras el trabajo pionero de Alfred Henry Sturtevant,[10] Benzer y colegas[11] utilizaron ginandromorfos (mosaicos sexuales) para desarrollar la nueva técnica de mapeo del destino. Esta técnica permitió asignar una característica particular a una ubicación anatómica específica. Por ejemplo, esta técnica demostró que el comportamiento de cortejo sexual masculino está controlado por el cerebro.[11]
El mapeo del destino del ginandromorfos también proporcionó la primera indicación de la existencia de feromonas en esta especie.[12] Los machos distinguen entre machos y hembras conespecíficos y dirigen el cortejo hacia las hembras, gracias a una feromona sexual específica que las hembras producen principalmente en sus tergitos (placas dorsales endurecidas del exterior del abdomen).
El genoma de D. melanogaster (secuenciado en 2000, y verificado en la base de datos FlyBase[3]) contiene cuatro pares de cromosomas: un par X/Y, y tres autosomas señalados como 2, 3, 4. El cuarto cromosoma es tan pequeño que a veces se ignora, salvo el importante gen sin ojos. El genoma secuenciado de D. melanogaster de 139,5 millones de pares de bases[14] contiene aproximadamente 15.016 genes. Más del 60% de su genoma es funcional al codificar ADN no codificador de proteínas[15] involucrados en el control de la expresión génica. La determinación de sexo en Drosophila se produce por la relación de cromosomas X a autosomas, no debido a la presencia de un cromosoma Y como ocurre en la determinación de sexo en humanos. Aunque el cromosoma Y es enteramente heterocromática, contiene al menos 16 genes, muchos de los cuales cumplen funciones relativas al sexo macho.[16]
Cerca del 75% de genes humanos vinculados con enfermedades, tienen su homólogo en el genoma de la mosca de la fruta,[17] y el 50% de las secuencias de proteínas de la mosca tiene su homólogo en mamíferos. Existe una base de datos en línea, llamada Homophila está disponible para estudios de enfermedades genéticas humanas homólogas en moscas y viceversa.[18] Drosophila sigue siendo usado extensamente como modelo genético para diversas enfermedades humanas incluyendo a desórdenes neurodegenerativos Parkinson, Huntington, ataxia espinocerebelosa y Alzheimer. Esta mosca también se usa en estudios de mecanismos del envejecimiento y estrés oxidativo, sistema inmunitario, diabetes, cáncer, abuso de drogas.
Drosophila melanogaster (en griego significa literalmente «amante del rocío de vientre negro»), también llamada mosca del vinagre o mosca de la fruta, es una especie de díptero braquícero de la familia Drosophilidae. Recibe su nombre debido a que se alimenta de frutas en proceso de fermentación tales como manzanas, bananas, uvas, etc. Es una especie utilizada frecuentemente en experimentación genética, dado que posee un reducido número de cromosomas (4 pares), breve ciclo de vida (15-21 días) y aproximadamente el 61 % de los genes de enfermedades humanas que se conocen tienen una contrapartida identificable en el genoma de las moscas de la fruta, y el 50 % de las secuencias proteínicas de la mosca tiene análogos en los mamíferos.
Para propósitos de investigación, fácilmente pueden reemplazar a los humanos. Se reproducen rápidamente, de modo que se pueden estudiar muchas generaciones en un corto espacio de tiempo, y ya se conoce el mapa completo de su genoma. Fue adoptada como animal de experimentación genética por Thomas Morgan a principios del siglo XX. Sus 165 Mb de genoma (1 Mb = 1 millón de pares de bases) fueron publicados en marzo de 2000 gracias al consorcio público y la compañía Celera Genomics. Alberga alrededor de 13.600 genes.
Harilik äädikakärbes ehk harilik puuviljakärbes (Drosophila melanogaster) on kahetiivaline putukas, keda kasutatakse tihti bioloogias katseloomana ja kes oli üks esimesi geneetiliselt uuritud loomi. 20. sajandi teisel poolel oli harilik äädikakärbes kõige levinum mudelorganism arengubioloogias.
Sõna Drosophila pärineb ladina keelest ja tähendab 'kaste armastaja'. Sõna tuleneb vanakreekakeelsetest sõnadest δρόσος, drósos, "kaste", "niiskus" ja φίλος, phílos, "armastav".[1]
Drosophila liike leidub kogu maailmas. Neid võib leida kõrbetes, troopilistes vihmametsades, linnades, soodes ja mägedes. Kõige rohkem on liike troopilistes piirkondades. Mõned põhjapoolsemad liigid hiberneeruvad. Äädikakärbsed paljunevad lagunevates taimedes ja seentes. Vastne toitub mädanevas puuviljas ja juurviljas leiduvatest bakteritest ning pärmist. Mõned Drosophila liigid, sealhulgas D. melanogaster, D. immigrans ja D. simulans, on oma eluviisilt tihedalt seotud inimestega ning on tuntud koduliikidena.[2]
Äädikakärbsel on umbes 50 tüüpi lõhnatajuneuronit, mis kannavad oma jätkeid pidi edasi elektriimpulsse iga lõhna puhul erinevalt. Kõik elektriimpulsid jõuavad umbes 2000 neuronisse, mida nimetatakse Kenyoni rakkudeks. Igat erinevat lõhna tajudes aktiveerub äädikakärbsel 2000 neuronist umbes 5%.[3]
Hariliku äädikakärbse genoom sisaldab 4 paari kromosoome: X/Y paar ja kolm autosoomi 2, 3 ja 4. Neljas kromosoom on väike, punktikujuline; X/Y (või esimene), 2. ja 3. kromosoom on metatsentrilised. Genoom koosneb umbes 132 miljonist aluspaarist ja sisaldab liigikaudu 13 792 geeni.[4] Praeguseks on nende genoom täielikult sekveneeritud ja annoteeritud.[5] Hariliku äädikakärbse karüotüüp (2n) sisaldab 8 kromosoomi.[6]
Diploidsel äädikakärbsel on 2 sugukromosoomi – XX ja XY, lisaks 3 paari autosoome (AA – A näitab ühte haploidset autosoomide kogumit, 2A diploidset). Soo määrab X-kromosoomide suhe autosoomide kordsusesse: normaalsetel isastel on see suhe 0,5 (1X:2A) ning normaalsetel emastel 1,0 (2X:2A). 2X:3A ning 3X:4A puhul jääb suhe 0,5 ja 1,0 vahele ning arenevad mõlemad sootunnused (intersex), 2X:4A puhul on suhe 0,5 ning kärbes on isane. Põhiline geen, mille avaldumine mõjutab sugu, on X-liiteline geen Sxl. Kui X:A suhe on suurem või võrdne ühega, on Sxl geen aktiivne ja sügoodist areneb emane kärbes; kui see suhe on väiksem või võrdne 0,5-ga, on geeni avaldumine alla surutud ja järglased tulevad isased. Juhul kui geeni Sxl produkti rakus pole (isased), seondub teatav valkkompleks paljudesse kohtadesse X-kromosoomil ja võimendab X-liiteliste geenide avaldumise taset kaks korda. Kui rakus on Sxl geeni produkti piisavalt, takistab see valkkompleksi seondumist ja seega ka geenide aktiivsuse tõusu.[7]
X-kromosoomid Autosoomid Suhe X:A Sugu XXXX AAAA 1 Normaalne emane XXX AAA 1 Normaalne emane XXY AA 1 Normaalne emane XXYY AA 1 Normaalne emane XX AA 1 Normaalne emane XY AA 0.50 Normaalne isane X AA 0.50 Normaalne isane (steriilne) XXX AA 1.50 Metaemane XXXX AAA 1.33 Metaisane XX AAA 0.66 Intersugu X AAA 0.33 MetaisaneÄädikakärbsed on oma kiire paljunemise tõttu väga populaarne sööt terraariumiloomadele. Nende kasvatamine toiduks on eriti oluline kahepaiksete ja roomajate pidamisel. Söödana on kõige levinum äädikakärbse tiibadeta vorm, sest neid on lihtsam püüda. Harilikku äädikakärbest kasvatatakse mõnikord ka akvaariumikalade toiduks.[8]
http://novaator.err.ee/259874/lugeja-kusib-kust-tulevad-aadikakarbsed
Harilik äädikakärbes ehk harilik puuviljakärbes (Drosophila melanogaster) on kahetiivaline putukas, keda kasutatakse tihti bioloogias katseloomana ja kes oli üks esimesi geneetiliselt uuritud loomi. 20. sajandi teisel poolel oli harilik äädikakärbes kõige levinum mudelorganism arengubioloogias.
Drosophila melanogaster euli-espezie bat da, Diptera ordenakoa eta Drosophilidae familiakoa. Oro har, ozpin-euli edota fruta-euli[1] esaten zaio; izan ere, hartzidura fasean dauden fruituez elikatzen da. Charles W. Woodworth entomologo amerikarrak euli-espezie hau organismo eredu moduan erabiltzeko proposatu zuenetik, D. melanogaster oso erabilia izan da zenbait arlotan genetikari buruzko ikerketak egiteko, besteak beste, biologian, fisiologian, mikroorganismoen patogenesian eta biziaren historiaren garapenean. Halaber, hainbat izan dira D. melanogaster euliarekin egindako ikerketei esker Nobel saria [2] irabazi duten ikerlariak.
Drosophila oso erabilia da ikerkuntzan, espezieak dituen ezaugarriak direla eta. Hasteko, euliak laborategian hazteko errazak dira eta haien ugalketa-zikloa oso azkarra izaten da. Bigarrenik, espezie honetako euliek lau kromosoma pare dituzte bakarrik [3]. Hirugarrenik, bizi-ziklo laburra dute, 15-21 egunekoa hain zuzen ere. Laugarrenik, zenbait gizakiren gaixotasunak eragiten dituzten geneen % 61 bat datoz ozpin-eulien genomarekin, eta eulien proteina-sekuentzien % 50ek analogoak dituzte ugaztunetan [4]. Azkenik, haien habitata oso zabala da; izan ere, kontinente guztietan aurki daitezke, baita uharteetan ere [5].
Tephritidae familiako euliei ere esaten zaie fruta-euli. Hori dela eta, denominazioa nahasgarria izan daiteke, batez ere, Mediterraneo aldean, Australian eta Hego Afrikan, non Mediterraneoko fruta-eulia, Ceratitis capitata, plaga ekonomikoa den.
D.melanogasterren bizi-zikloak 21 egun irauten du, arrautzatik irteten denetik hiltzen den arte.[6]
D.melanogasterren garapen prozesua tenperaturaren menpekoa da. Garapen prozesuak arrautzatik hasi eta heldu bihurtu arte irauten du. Garapen-denbora laburrena 7 egunekoa izaten da, eta 28 °C-tan lortzen da. Garapen prozesua luzatu egiten da tenperatura igo ahala: 19 egunekoa da 18 °C-tan, eta 50 egun baino gehiagokoa tenperatura 12 °C-koa denean. Tenperatura optimoa 25 °C-koa da, euliak 8,5 egunetan garatzea eragiten duena. Emeek gutxi gorabehera 0,5 mm-ko 400 arrautza inguru erruten dituzte usteldutako frutan edo perretxikoetan. Baldintza optimoetan (25 °C) 12-15 ordu iragandakoan eklosionatzen dute arrautzek, eta horietatik irteten diren larbek, 4 egun pasatu ondoren, pupa bihurtu eta metamorfosia jasaten dute. Metamorfosiaren ostean, heldu bilakatzen dira. Larba direlarik, bitan aldatzen dute azala (exubiazioa), arrautzatik irten eta 24 eta 48 ordura.[7] Garapen-fase horretan, fruta usteltzen duten mikroorganismoez eta frutak berak dauzkan azukreez elikatzen dira.[8]
Ozpin-euli arrek emeak gorteatu behar dituzte, ugaldu baino lehen. Gorteatze prozesu horrek bost fase ditu, zeinetan arrak emea erakartzen saiatzen den hegoen bibrazioen eta bestelako taktiken bitartez, emeak onartzen duen arte. Emeek arrak errefusa ditzakete horiei ostikoak emanez edo alde eginez.[9] Euli emeak arra onartzen badu, kopulazioak 15-20 minutu irauten du.[10] Emeek bikote batekin baino gehiagorekin kopulatu ohi dute. Beraz, eme bakarrak errunaldi bakarrean ar baten baino gehiagoren arrautzak ipintzen ditu. Hori gertatzen da D.melanogaster emeek kopulatzen dituzten arren esperma gordetzen dutelako euren gorputzaren barruan. Ar desberdinen espermek lehiatu egiten dute emearen obuluak ernaltzeko.[11] Zientzialariek uste dute kopulatzen azkena izan den arrak arrautzen % 80ren aita izango dela lehia horren ondorioz. Ernalketa gertatu ostean, emearen umetokiko neurona sentsorialek arren esperman dagoen proteina bati, sexu-peptidoari, erantzuten diote. Proteina horrek emeak ernalketa gertatu osteko 10 egunetan kopulatzea ekiditen du. Neurona sentsorialak sexu-peptidoaren aurrean kitzikatzen dira eta eulietan hipotalamoaren homologoa den garunaren gunera bidaltzen dute seinalea. Ondoren, hipotalamoak desira eta jokaera sexuala kontrolatzen ditu. Prozesu horren bide metabolikoa ondo deskribatuta dago.[12]
D. melanogaster bizitzaren luzera aztertzen duten ikerketetan erabiltzen da, mutatutakoan eulien bizitza luzatzen duten geneak identifikatzeko adibidez.[13]
Emeak azaleratu eta 8-12 ordu igaro ostean arrentzako harkor bihurtzen dira eta, gainera, arren hautapenean eta horiekiko portaeran eragiten duten neurona talde espezifikoak aurkitu dira.[14] Emeek badituzte nerbio abdominaleko neurona jakin batzuk zeinek gorputzeko mugimenduak pausaraz ditzaketen kopulatzeko.[15] Neurona horien aktibazioak emeak bere mugimenduak gelditu eta arraren norabidean orientatzea eragiten du, estalketa baimentzeko helburuarekin. Neurona talde espezifiko hori aktibo ez badago, aldiz, emeak bere mugimenduarekin jarraitzen du eta ez da kopulaziorik gertatzen. Arren feromonak bezalako seinale kimikoek neuronen talde horien aktibazioa susta dezakete.[16] Horrez gain, emeek arren hautapena kopiatzen dute; hau da, birjinak direnean, beste emeak ar mota jakinekin kopulatzen ikusten badituzte, mota horretako arrekin kopulatzeko joera izaten dute. Portaera hori ingurumen-aldaketekiko sentikorra da: emeek gutxiago kopulatzen dute eguraldia txarra denean.[17]
D. melanogaster espezieko arrek haien esperientzia sexuala erabiltzen dute etorkizuneko portaera sexuala aldatzeko. Aldaketa horiek, besteak beste, harkortasun-denbora motzagoak eta espezifikoagoak izatea eragiten dutela dirudi. D. simulans espezieko euliekin gertatzen den moduan, D. melanogaster espezieko ar "inozoek" nahiko denbora behar dute harkorrak izateko, eta hasieran, oraindik sexualki aktiboak ez diren emeak gorteatzen saiatzen dira, baita beste ar batzuk ere. D. melanogaster espezieko arrek ez dute lehentasunik erakusten D. melanogaster espezieko emeekiko, beste espezie batzuetako emeekiko edo beste euli arrekiko. Hala ere, D. simulans edo beste euli-espezie batzuekiko gorteatzea eraginkorra ez dela ikusita, D. melanogaster espezieko arrek euren portaera moldatzen ikasi dute, ugalketa-helbururik ez duten prozesuetan gehiegizko energia ez galtzeko.[18]
Horrez gain, esperientzia sexual zabala duten euliek azkarrago ugaltzeko gaitasuna dute; izan ere, denbora gutxiago ematen dute emea gorteatzen eta, beraz, estaltze-sortasun baxuagoak izango dituzte. Horren ondorioz, esperientzia duten arrek etekin handiagoa lortzen dute estalketan ar sineskorrek baino.[19] Horrek abantaila ebolutiboak eskaintzen dizkie, oso garrantzitsuak direnak hautespen naturalaren aldetik ikusita.
Fruta-euli basatiak hori-marroixkak dira, begi gorriak dituzte eta zeharkako eraztun beltza ere sabelean. Dimorfismo sexuala erakusten dute: emeek 2,5 mm-ko luzera dute eta, arrak, aldiz, apur bat txikiagoak dira, eta atzeko alde beltzagoa dute. Arrak erraz bereizten dira emeetatik begi-bistaz, koloreen ezberdintasuna dela eta. Alde batetik, sabelean gune beltz bereizgarria dute, jaioberrietan gutxiago nabaritzen dena. Bestetik, arrek sexu-orrazia dute, hau da, zurda beltzen ilara lehenengo hankaren tartsoan. Gainera, emeari lotzeko duten gunea ile zorrotzez inguratuta dago. Argazki ugari aurki daitezke FlyBase orrialdean.[20]
Drosophila euliek X eta Y kromosomak eta autosomak dituzte. Gizakietan ez bezala, Y kromosomak ez du ar-ezaugarririk eragiten, baina hazia sortzeko ahalmena duten geneak kodetzen ditu. Sexua, ordea, X kromosomen eta autosomen arteko proportzioak determinatzen du. Bestetik, zelula bakoitzak arra edo emea izatea "erabaki" dezake, organismoaren beste zelulak "kontuan hartu" gabe. Jokaera horrek ohikoa den ginandromorfismoa eragiten du, alegia, bi sexuen ezaugarri fisikoak adieraztea.
Hiru gene nagusik parte hartzen dute Drosophilaren sexu-determinazioan. Horiek dira: sex-lethal, sisterless, eta deadpan. Gene horien kantitateak eragin handia du euli baten sexuan, hiru geneek elkar inhibitzen baitute. Hiru geneetatik zeintzuk adierazten diren eta zein kantitatetan adierazten diren, horren arabera erabakiko da euliaren amaierako sexua.
X Kromosomak Autosomak X:A proportzioa Sexua XXXX AAAA 1 Eme arrunta XXX AAA 1 Eme arrunta XXY AA 1 Eme arrunta XXYY AA 1 Eme arrunta XX AA 1 Eme arrunta XY AA 0.50 Ar arrunta X AA 0.50 Ar arrunta (antzua) XXX AA 1.50 Metaemea XXXX AAA 1.33 Metaemea XX AAA 0.66 Intersexua X AAA 0.33 MetaemeaD. melanogaster espezieko euliak analisi genetikorako hautatu ziren lehen organismoak dira eta, beraz, organismo eukariotoen artean, genetikoki hobekien ezagutzen den eta gehien erabiltzen den eredua. Organismo guztiek antzeko sistema genetikoak erabiltzen dituzte eta, ondorioz, transkripzioa eta erreplikazioa bezalako prozesuak ozpin-eulietan ulertzeak ahalbidetzen du gainerako eukariotoetan ere antzeko prozesuak ulertzea, gizakiarenak ere bai.[21] Fruitu-eulia lehenengo aldiz erabili zen herentzia aztertzeko ikerkuntzetan 1910.urtean Columbia Unibertsitatean, Thomas Hunt Morganen esku.[22]
Esan bezala, D.melanogaster espezieko euliak oso erabiliak izan dira ikerkuntza biologikoan, zenbait arrazoi direla eta:
Markatzaile genetikoak oso erabiliak dira Drosophila melanogaster espezieko eulietan eta, horrela, fenotipo gehienak erraz identifikatu daitezke mikroskopio baten laguntzarekin. Jarraian, markatzaile genetiko batzuk zerrendatu dira: aleloaren ikurra eta erasandako genearen izena zehaztu dira, baita fenotipo desberdinen azalpenak ere. Alelo errezesiboak letra xehez ageri dira eta alelo dominanteak, aldiz, letra larriz.
D. melanogaster euli-espezieak lau kromosoma pare ditu: X/Y parea eta hiru autosoma pare, hain zuzen ere. Laugarren kromosoma oso txikia da, eta askotan ez da kontuan hartzen. Hala ere, begien gabezia eragiten duen geneak kromosoma horretan kokaturik dago. D. melanogaster espeziearen genoma 139.5 milioi [26] base parek osatzen dute, eta 15682 gene ditu. Genomaren % 60 baino gehiago, geneen adierazpena kontrolatzen duen proteina kodetzen ez duen DNA [27] funtzionala dela dirudi. Sexuaren determinazioa D. melanogaser eulian X kromosomen eta autosomen arteko proportzioaren araberakoa da, gizakietan ez bezala. Nahiz eta Y kromosoma guztiz heterokromatikoa izan, gutxienez 16 gene ditu eta horietako askok arrekin erlazionaturiko funtzioak dituzte [28].
2000. urtean fruta-euliaren genomaren eta giza genomaren alderaketa gauzatu zen National Human Genome Research Istitutek egindako ikerketa batean. Egindako estimazioaren arabera, geneen % 60 bat datoz giza genomarekin [29]. Zenbait gizakiren gaixotasunak eragiten dituzten geneen % 75 ozpin-eulien genoman ageri dira, eta eulien proteina-sekuentzien % 50ek analogoak dituzte ugaztunetan . D. melanogaster eredu genetiko modura erabiltzen da zenbait gaixotasun aztertzeko, besteak beste, Parkinson gaixotasuna eta Alzheimer gaixotasuna [30]. Euli-espezie hau estres oxidatiboan, zahartze prozesuan, diabetes gaixotasunean eta minbizian eragiten dituzten mekanismoak aztertzeko erabiltzen da [31][32][33].
D.melanogasterren garapen prozesuak lau fase ditu: arrautza, larba, pupa eta euli heldua. [34]
D.melanogaster ikerketa genetikoetan oso erabilia izan den organismo modeloa da. Haren garapen prozesua sakon ikertu da, abantaila asko eskaintzen baititu beste animalia eredu batzuekin alderatuta: tamaina txikia, garapen-denbora laburra eta arrautza kopuru handia errunaldi bakoitzean.
Oozitoa ernaldu ostean, sortu berri den enbrioiak hainbat DNA-bikoizketa jasaten ditu, eta 13 nukleo-zatiketa. Prozesu horren ondoren, 5000 eta 6000 nukleo artean egoten dira zelula bakarrean, zitoplasma partekatzen. Nukleo horiek zitoplasmaren gune desberdinetara migratzen dute, gehienek enbrioiaren azalera, eta beste batzuek enbrioiaren erdialdera. Azken horiek bitelo-zakua osatzen dute. Nukleo-zatiketak oso azkar gertatzen dira, kontrol handirik gabe, eta, beraz, akatsak egon daitezke DNAn. Akasdun nukleoek enbrioiaren erdialdera migratzen dute, bitelo-zakuko zelula bihurtzeko, gune hori ez baita euliaren gorputzaren parte izango. Hasierako garapen-faseetan aldaketa asko gertatzen dira enbrioian, eta ezagunak diren gene askok parte hartzen dute horietan. Gene-sare hau hobekien deskribatuta dagoen gene-sareetako bat da.
Gastrulazioan eta hasierako garapen-faseetan zehar enbrioiak mugimendu morfogenetiko ugari jasaten ditu: mesodermoaren eta endodermoaren hainbat inbaginazio, gorputz-atalen segmentazioa, etab. Arrautzatik irten ostean, larba fasean sartzen da. Fase horretan disko imaginalak sortzen hasten dira larban. Disko horiek zelula epitelialen multzoak dira, pupa fasean euliaren kanpoko egitura bilakatuko direnak. Zelula multzoak disko moduan antolatzen dira, hortik datorkie izena.
Larba fasea amaitzean, metamorfosia gertatzen da. Prozesu horretan zehar, larba pupa bihurtzen da. Larba osatzen zuten ehunak birxurgatu egiten dira, eta disko imaginalek mugimendu morfogenetiko asko jasaten dituzte, euli helduen egiturak sortu arte, adibidez: burua, hegoak, toraxa eta sexu-organoak.[35]
Drosophila melanogaster euli-espezie bat da, Diptera ordenakoa eta Drosophilidae familiakoa. Oro har, ozpin-euli edota fruta-euli esaten zaio; izan ere, hartzidura fasean dauden fruituez elikatzen da. Charles W. Woodworth entomologo amerikarrak euli-espezie hau organismo eredu moduan erabiltzeko proposatu zuenetik, D. melanogaster oso erabilia izan da zenbait arlotan genetikari buruzko ikerketak egiteko, besteak beste, biologian, fisiologian, mikroorganismoen patogenesian eta biziaren historiaren garapenean. Halaber, hainbat izan dira D. melanogaster euliarekin egindako ikerketei esker Nobel saria irabazi duten ikerlariak.
Drosophila oso erabilia da ikerkuntzan, espezieak dituen ezaugarriak direla eta. Hasteko, euliak laborategian hazteko errazak dira eta haien ugalketa-zikloa oso azkarra izaten da. Bigarrenik, espezie honetako euliek lau kromosoma pare dituzte bakarrik . Hirugarrenik, bizi-ziklo laburra dute, 15-21 egunekoa hain zuzen ere. Laugarrenik, zenbait gizakiren gaixotasunak eragiten dituzten geneen % 61 bat datoz ozpin-eulien genomarekin, eta eulien proteina-sekuentzien % 50ek analogoak dituzte ugaztunetan . Azkenik, haien habitata oso zabala da; izan ere, kontinente guztietan aurki daitezke, baita uharteetan ere .
Tephritidae familiako euliei ere esaten zaie fruta-euli. Hori dela eta, denominazioa nahasgarria izan daiteke, batez ere, Mediterraneo aldean, Australian eta Hego Afrikan, non Mediterraneoko fruta-eulia, Ceratitis capitata, plaga ekonomikoa den.
Banaanikärpänen (Drosophila melanogaster) on pieni kellanruskea mahlakärpäslaji, joka on jo vuosikymmenten ajan ollut yksi kokeellisen biologisen tutkimuksen tärkeimmistä malliorganismeista. Yleiskielessä banaanikärpäsellä voidaan tarkoittaa myös koko mahlakärpästen heimoa tai useita muita Drosophila-suvun lajeja, joista monet ovat Suomessa huomattavasti D. melanogaster -lajia yleisempiä.
Vaikka banaanikärpänen on tavallinen vieras suomalaisissakin kodeissa, se ei pysty talvehtimaan Suomessa vaan kanta on riippuvainen Baltian maista saapuvista ja kauppojen hedelmien mukana tulevista yksilöistä. Ravinnokseen mahlakärpäslajit imevät käymistilassa olevia nesteitä, esimerkiksi hedelmien mehua ja mahlaa. Toukat elävät esimerkiksi mahlassa tai maahan pudonneissa marjoissa ja hedelmissä syöden nesteitä sekä hiivoja ja muita mikro-organismeja.
Banaanikärpäsen biologisella tutkimuksella on pitkä historia. Nykyäänkin se on yksi yleisimmin käytetyistä malliorganismeista, josta on eristetty laboratoriokasvatuksiin tuhansia genotyypiltään erilaisia mutanttikantoja. Lajin yksilöitä käytetäänkin lähes kaikilla biologian osa-alueilla. Erityisesti banaanikärpäsiä käytetään geneettisissä, kehitysbiologisissa ja fysiologisissa tutkimuksissa, joissa voidaan selvittää muun muassa muistin toimintaa tai alkoholin vaikutuksia. Lajin koko genomin emäsjärjestys selvitettiin jo vuonna 2000. Koska ihmisen ja banaanikärpäsen geenitoimintojen on havaittu olevan pohjimmiltaan melko samanlaisia, voidaan kärpäsellä saatuja tuloksia soveltaa usein myös ihmisellä.
Banaanikärpäsen suosioon malliorganismina ovat vaikuttaneet monet seikat, mutta erityisesti sen helppo kasvatettavuus, taudinkestävyys, lyhyt sukupolvenkierto ja mutaatioiden synnyttämisen helppous nostivat sen tutkijoiden suosioon jo 1900-luvun alussa. Nykyään samoja ominaisuuksia käyttävät hyväkseen muun muassa monet matelija- ja akvaarioharrastajat, jotka käyttävät siivettömiä banaanikärpäsen mutanttikantoja lemmikkiensä elävänä ravintona.
Banaanikärpänen on kellanruskea, raidallinen ja punasilmäinen pieni kärpänen. Banaanikärpänen on sukupuolidimorfinen laji, eli sen koiraan ja naaraan ulkonäöt poikkeavat toisistaan. Naaraat ovat noin 2,5 millimetriä pitkiä, ja koiraat ovat hieman tätä pienempiä. Sukupuolten välisiä muita eroja ovat esimerkiksi koiraan peräaukon ja sukupuolielimien ympärillä olevat piikkimäiset karvat ja koiraan ensimmäisessä raajaparissa sijaitsevat sukaskimput (engl. sex combs), jotka puuttuvat naaraalta. Koiraan takaruumis on kapeampi, sen kärki tummempi eivätkä takaruumiin alapuoliset sukupuolielimet ole yhtä selvästi näkyvillä koirailla kuin naarailla.[3]
Banaanikärpäsestä on eristetty laboratoriossa tuhansia erilaisia mutanttikantoja, joiden ulkonäkö saattaa poiketa huomattavasti villityypistä. Esimerkiksi white (w) -mutantin silmät ovat valkoiset ja forked (f) -mutantin selkäpuolen karvat ovat koukkupäisiä. Mutaatioiden seuraukset voivat olla myös huomattavasti dramaattisempia. Esimerkiksi wingless (wg) -mutantit ovat kokonaan siivettömiä.[4] Listaa kaikista tunnetuista ja tutkimuslaitoksissa ylläpidetyistä Drosophilan mutanttikannoista ylläpidetään FlyBase:ssa, jonka kautta tutkijat voivat myös ottaa yhteyttä toisiin laboratorioihin tai kantakeskuksiin tilatakseen itselleen erilaisten mutanttikantojen yksilöitä.
Banaanikärpäsen elinkierron pituus vaihtelee lämpötilan mukaan kuten kaikilla vaihtolämpöisillä eliöillä. Elinkierto on lyhimmillään 28 °C:ssa, jolloin kärpäsen kehitys munasta aikuiseksi vie seitsemän päivää. Tätä korkeammissa lämpötiloissa kehitys hidastuu korkeamman lämpötilan aiheuttaman fysiologisen stressin vuoksi; esimerkiksi 30 °C:ssa kehitys kestää 11 päivää. Ihanteellisissa olosuhteissa, 25 °C:ssa, kehitys vie 8,5 päivää. Tätä alemmissa lämpötiloissa kehitys hidastuu: 18 °C:ssa kuluu 19 päivää ja 12 °C:ssa kuluu yli 50 päivää.[3] Jos kärpäsiä on samassa paikassa paljon, hidastaa se kärpästen kehitystä.[5] Ne myös jäävät kooltaan pienemmiksi.[6]
Naaraat laskevat suurin piirtein 400 munaa sopivalle alustalle noin viisi kappaletta kerrallaan. Kooltaan 0,5 mm:n mittaiset munat kuoriutuvat 12–15 tunnin kuluttua (25 °C:ssa) ensimmäisen toukkavaiheen toukiksi. Toukat kasvavat noin neljä päivää, luoden nahkansa kaksi kertaa noin 24 ja 48 tunnin kuluttua kuoriutumisesta. Ensimmäisen nahanluonnin jälkeen toukkia kutsutaan toisen toukkavaiheen toukiksi, ja kolmas toukkavaihe alkaa toisen nahanluonnin jälkeen. Tämän jälkeinen kotelovaihe ja metamorfoosi kestävät neljä päivää, jonka kuluttua aikuiset kuoriutuvat. Naaraat ovat parittelukypsiä noin 8–12 tunnin kuluttua kuoriutumisesta. Aikuinen banaanikärpänen elää noin 30 päivää.[3]
Banaanikärpäsen alkionkehitystä eli embryogeneesiä on tutkittu erittäin paljon, ja varhaisen alkion kehitystä säätelevä geeniverkosto on yksi parhaiten tunnetuista säätelyverkostoista. Suosion taustalla ovat olleet samat ominaisuudet, jotka ovat tehneet banaanikärpäsestä genetiikan malliorganismin. Banaanikärpäsen alkionkehitys eroaa tosin muiden malliorganismien kehityksestä. Sen vakoutuminen nimittäin tapahtuu syncytiumissa, joka on useissa tumanjakautumisissa ilman solunjakautumista syntynyt monitumainen solu. Oogeneesin aikana rengaskanaviksi (engl. ring canals) kutsutut solulimasillat yhdistävät muodostuvan oosyytin syöttösoluihin, joista kulkeutuu oosyyttiin ravinteita ja kehitystä sääteleviä molekyylejä.[7]
Oosyytistä kehittyvän munasolun hedelmöityksen jälkeen varhainen alkio käy läpi useita DNA:n monistumiskertoja, mutta vain muutamia tumanjakautumisia. Vasta myöhemmissä kehityksen vaiheissa alkion solut eroavat erillisiksi soluiksi. Koska DNA:n monistuminen eli replikaatio varhaisessa alkiossa on niin nopeaa, ei solusyklissä ole juurikaan tarkastuspisteitä (engl. checkpoints) estämässä virheellisten solujen muodostumista. Sen vuoksi syntyneet virheelliset solut vaeltavat alkion ruskuaispussiin, joka ei muodosta aikuisen kärpäsen rakenteita. Alkio käy kehityksensä aikana läpi useita vaiheita, jotka ovat erittäin hyvin tunnettuja, kunnes se lopulta kuoriutuu ensimmäisen toukkavaiheen toukkana.[7]
Toukan kehityksen aikana imaginaalilevyinä (engl. imaginal discs) tunnetut kudokset kasvavat toukan sisällä. Imaginaalilevyt muodostavat kehittyessään suurimman osan aikuisen kärpäsen rakenteista, kuten pään, jalat, siivet ja sukupuolielimet. Niiden solut erkanevat muista solulinjoista jo alkionkehityksen aikana ja niiden jakautuminen jatkuu myös toukkavaiheiden aikana, toisin kuin useimpien muiden toukan solukkojen. Kotelovaiheen aikana imaginaalilevyjen kudokset läpikäyvät monia voimakkaita muutoksia, jotta ne voivat muodostaa aikuisen kärpäsen rakenteita.[8]
Banaanikärpänen on kosmopoliitti laji, joka on levinnyt kaikkialle maailmaan.[9][10] Sitä tavataan luonnossa myös Suomessa.[11][9] Laji ei kuitenkaan pysty talvehtimaan Suomessa muutamien muiden suvun lajien tavoin, vaan kanta on riippuvainen Baltian maista saapuvista ja osin myös kauppojen hedelmien mukana tulevista yksilöistä.[9][12] Sen sijaan esimerkiksi lähisukuinen D. littoralis pystyy selviämään talven yli jopa pohjoisimmassa Suomessa.[12] Yhteensä luonnonvaraisia Drosophila-kärpäsiä Suomessa tavataan noin 30 lajia.[9] D. melanogasterin luonnonkanta on runsaimmillaan loppukesästä, jolloin kärpäsiä etsiytyy ihmiskoteihin. Banaanikärpäset, kuten muutkin mahlakärpäset, viihtyvät kosteissa ja varjoisissa paikoissa. Ne ovat aktiivisimmin liikkeellä pääasiassa illalla.[13]
Ravinnokseen mahlakärpäslajit imevät käymistilassa olevia nesteitä, esimerkiksi sokeripitoisia hedelmiä ja puiden mahlaa. Toukat elävät mahlassa, sienissä, maahan pudonneissa marjoissa ja pilaantuneissa hedelmissä syöden niiden nesteitä sekä erityisesti niissä kasvavia hiivoja ja muita mikro-organismeja.[13] Banaanikärpänen pystyy tunnistamaan makean ja kitkerän maun, mutta ei esimerkiksi chilipippurille tyypillistä polttavaa kapsaisiinia.[14]
Banaanikärpäset pyrkivät parittelemaan mahdollisimman pian kuoriutumisensa jälkeen. Naaraat ovat halukkaita paritteluun jo 8–12 tuntia kuoriutumisesta.[15] Sitä nuorempia, parittelemattomia naaraita kutsutaan usein virgiineiksi naaraiksi.[16] Banaanikärpäskoiraan kosiokäyttäytyminen muodostuu viiden toiminnon sarjasta, jonka se suorittaa houkutellakseen naaraita parittelemaan kanssaan. Ensin koiraat suoristavat itsensä ja värisyttävät siipiään kosioäänen muodostamiseksi. Pian sen jälkeen koiras siirtyy matalana naaraan takaruumiin taakse ja alkaa kosketella naaraan genitaaleja jaloillaan ja imukärsällään. Lopulta koiras käyristää takaruumistaan ja yrittää parittelua. Naaras voi torjua koiraan joko siirtymällä kauemmas tai työntämällä munanasettimensa ulos. Onnistunut parittelu kestää 10 minuuttia, jonka aikana koiras siirtää satoja siittiöitä naaraaseen. Naaras pystyy säilömään spermaa, joka voi joutua siten myös kilpailemaan munasolujen hedelmöityksestä muiden koiraiden siittiöiden kanssa.[17]
Banaanikärpänen on useimpien kärpäslajien tavoin erittäin taitava lentäjä. Sen siivet pystyvät lyömään jopa 220 kertaa sekunnissa.[18] Lentävä banaanikärpänen on myös hyvin ketterä, sillä se voi muuttaa lentosuuntaansa yhdeksänkymmentä astetta jopa alle viidessäkymmenessä millisekunnissa.[19] Banaanikärpäsellä, kuten todennäköisesti monilla muillakin kärpäsillä, näköhermot ovat myös suoraan yhteydessä siipilihaksiin. Tämä mahdollistaa kärpäsen erittäin nopean reagoinnin liikkeeseen, jopa ilman aivojen väliintuloa.[18]
Banaanikärpäsen kehittynein aisti on näkö. Noin kahta kolmasosaa banaanikärpäsen aivoista, yhteensä noin 200 000 neuronia, käytetään pelkästään näköaistimusten tulkitsemiseen. Vaikka banaanikärpäsen tilan hahmottamiskyky on huomattavasti huonompi kuin ihmisillä, näköaistimusten käsittelyn nopeus (ajallinen resoluutio) on noin kymmenen kertaa ihmistä nopeampi. Tämä yhdessä lentolihasten ja silmien suoran yhteyden kanssa mahdollistaa petojen tehokkaamman välttämisen ja paremman lennon hallinnan.
Banaanikärpäsen erittäin hyvin kehittyneet verkkosilmät koostuvat 800 pienemmästä silmäyksiköstä, ommatidista. Jokainen ommatidi koostuu kahdeksasta valoreseptorisolusta (nimetty R1–8), niiden tukisoluista, pigmenttisoluista ja verkkokalvosta. Silmien normaali voimakkaan punainen väri johtuu pigmenttisoluista, jotka imevät ylimääräisen sinisen päivänvalon ja siten estävät kärpästä sokaistumasta kirkkaassakaan auringonpaisteessa.[20]
Banaanikärpänen on yksi tutkituimmista organismeista ja biologian malliorganismeista. Kalifornian yliopiston perinnöllisyystieteen professori Charles W. Woodworth oli ensimmäinen tutkija, joka kasvatti suurempia määriä banaanikärpäsiä laboratoriossa.[9] Kokeellisen tutkimuksen banaanikärpäsellä aloitti Woodworthin ehdotuksesta Harvardin yliopiston professori William Ernest Castle, jonka oppilas ja työtoveri Frederic Carpenter julkaisi ensimmäisen tieteellisen artikkelin banaanikärpäsestä 1905. Merkittävin 1900-luvun alun banaanikärpästutkijoista oli kuitenkin Columbian yliopiston professori Thomas Hunt Morgan ryhmineen. Hän teki monia kokeita banaanikärpäsillä ja löysi muun muassa 1910 banaanikärpäsen ensimmäisen mutantin, whiten, joka muutti kärpäsen silmät valkoisiksi. Morgan paikallisti mutatoituneen geenin banaanikärpäsen X-kromosomiin, todistaen samalla, että geenit sijaitsevat kromosomeissa. Thomas Hunt Morganille myönnettiin 1933 Nobelin lääketieteen palkinto banaanikärpästen genetiikkaan kohdistuneista tutkimuksista.[9][21]
Ensimmäisen kromosomikartan banaanikärpäselle laati vuonna 1913 Alfred H. Sturtevant, joka työskenteli myös Morganin ryhmässä. T. H. Morgan itse julkaisi ensimmäiset tarkat fysikaaliset paikat useille banaanikärpäsen geeneille vuonna 1938. Banaanikärpäsellä tehdyn varhaisen mutaatiotutkimuksen uranuurtaja 1920-luvulla puolestaan oli Hermann J. Muller, joka indusoi mutaatioita röntgensäteilyn avulla. Keksinnöstään Muller sai lääketieteen Nobelin 1946. Myös evoluutiotutkimusta banaanikärpäsellä tehtiin jo varhain. Yhdysvaltalainen Theodosius Dobzhansky todisti 1930- ja 1940-luvuilla banaanikärpäsen avulla luonnonvalinnan toimivan luonnonpopulaatioissa sekä pystyi selvittämään eri Drosophila-lajien fylogenian.[9]
Pelkkä sattuma tai tutkimuksen pitkä historia eivät ole syynä banaanikärpäsen suosioon tutkimuskohteena tai sen valintaan tutkimuksen malliorganismiksi. Banaanikärpäsen käyttöön ovat tutkimuksen historian aikana vaikuttaneet useat seikat, kuten:[16][21]
Jo olemassa olevan tiedon ja tutkimuksen valtava määrä jouduttaa myös uutta tutkimusta. Banaanikärpäsellä tehdään nykyään tutkimusta lähes kaikilla biologian osa-alueilla. Viime aikojen suurimpia saavutuksia banaanikärpästutkimuksessa on ollut sen koko genomin sekvensointi vuonna 2000.[22][23] Samoin monien uusien geenimuuntelutekniikoiden kehitys ja mahdollisuus hankkia useimpia tunnettuja mutanttikantoja tutkittavaksi Internetin välityksellä on helpottanut tutkimusta huomattavasti. Nykyään banaanikärpästä käytetään tutkimuskohteena yhtä lailla kehitysbiologiassa, geenien vuorovaikutusten tutkimuksessa, fysiologiassa kuin ihmisten tautien mallintamisessakin. Banaanikärpäsen käyttöä erityisesti ihmisen sairauksien tutkimuksessa puoltaa varsinkin mahdollisuus tehdä erittäin monenlaisia geneettisiä kokeita. Muun muassa kontrolloitujen risteytysten sekä poistogeenisten yksilöiden tuottaminen on banaanikärpäsellä huomattavan helppoa ja lyhyen sukupolvenkierron vuoksi kokeiden tulokset ovat nopeasti nähtävissä.
Esimerkiksi alkoholin vaikutusten ja alkoholismin tutkimuksessa banaanikärpästä on käytetty erittäin paljon. Banaanikärpästen ja nisäkkäiden alkoholivaste on erittäin samankaltainen: esimerkiksi kärpästen liikkeiden kontrolli heikkenee jo pienen alkoholialtistuksen vaikutuksesta ja annosta lisättäessä ne menettävät liikuntakykynsä täysin. Pitkäaikaisessa altistuksessa kärpäsille kehittyy myös toleranssia alkoholia vastaan. Alkoholinsietokyvyltään erilaisten kärpäskantojen geneettinen tutkimus onkin paljastanut useita alkoholiherkkyyteen vaikuttavia geenejä, joille on löydettävissä vastingeenit myös ihmisestä. Siten kärpäsellä tehtävä tutkimus voi paljastaa yksityiskohtia myös ihmisten alkoholismin perinnöllisyydestä.[24]
Alkoholitutkimuksen lisäksi myös muistin mekanismien selvittämisessä banaanikärpänen on osoittautunut oivalliseksi tutkimuskohteeksi. Sen on osoitettu pystyvän oppimaan monenlaisia asioita, kuten erilaisia käyttäytymismalleja. Banaanikärpäseltä onkin onnistuttu löytämään useita tärkeitä oppimiseen ja muistiin vaikuttavia geenejä. Niiden selvittämiseen on käytetty useita erilaisia geneettisiä tutkimusmenetelmiä, kuten esimerkiksi geenien hiljentämistä ja DNA-mikrosirutekniikkaa. Banaanikärpäsellä tehdyissä pavlovilaisissa käyttäytymiskokeissa puolestaan on pystytty eristämään oppimisvaikeuksellisia kärpäskantoja yhdistämällä tietyt tuoksut sähköshokkiin. Näistä eristetyt mutatoituneet geenit (esimerkiksi dunce, rutabaga ja amnesiac) ovat osoittautuneet tärkeiksi muistin kehityksessä. Tuoreet tutkimukset ovat myös paljastaneet banaanikärpäsen pitkäaikaiseen muistiin vaikuttavia geenejä. Eräiden tutkijoiden mukaan banaanikärpäsen muisti- ja oppimistutkimuksessa ollaankin lähitulevaisuudessa pääsemässä vaiheeseen, jossa voidaan siirtyä yksittäisten geenien tutkimisesta jopa koko muistin kehityksen vuorovaikutusverkoston tutkimukseen.[25][26]
Banaanikärpäsen kromosomisto on pieni: sen diploidinen kromosomiluku 2n = 8. Kromosomipareista kolme on autosomeja ja yksi on sukupuolikromosomipari (X ja Y). Historiallisista syistä banaanikärpäsen X-kromosomia merkitään usein numerolla 1, ja autosomit ovat kromosomit 2–4. Neljäs kromosomi jätetään usein huomiotta sen pienen koon takia, sillä siinä on geenejä sisältävää eukromatiinia vain noin miljoona emäsparia.[22] Geenejä neljännessä kromosomissa on alle sata.[27] Kärpäsen sukupuoli määräytyy X-kromosomien ja autosomien suhteen perusteella, eikä Y-kromosomilla ole siihen vaikutusta toisin kuin esimerkiksi ihmisellä. Jos siis X-kromosomeja on yksi, X-kromosomien ja autosomien suhde on 1:6, jolloin syntyy koiras. Jos X-kromosomeja on kaksi, suhde on 2:6, jolloin syntyy naaras.[28] Banaanikärpäsen Y-kromosomi on myös lähes kokonaan heterokromatiinia.[22]
Drosophilan genomi on noin 180 miljoonan emäsparin (Mb) suuruinen. Genomista kolmasosa on heterokromatiinia ja loput noin 120 Mb eukromatiinia.[22] Vaikuttaa siltä, että noin 60 prosenttia kärpäsen genomista ei sisällä proteiineja koodaavia geenejä.[29] Tällä hetkellä genomin arvioidaan sisältävän 14 601 geeniä.[27] Koko genomi on sekvensoitu vuonna 2000, ja suurin osa siitä on sen jälkeen myös varustettu selityksin eri alueiden biologisesta toiminnasta (engl. annotated).[22] Geneettisesti banaanikärpänen on noin 60-70 -prosenttisesti ihmisen kaltainen, ja vajaalle 3000 banaanikärpäsen geenille on löydettävissä todennäköisesti samaa alkuperää oleva vastingeeni ihmisestä.[21][30] Noin 77 prosentille ihmisen geeneistä, joiden mutaatioiden tiedetään olevan jonkin sairauden syynä, on löydettävissä homologinen vastine banaanikärpäsen genomista.[31] Siten banaanikärpästä voidaan käyttää vertailevassa genomiikassa myös ihmisen ja muiden nisäkkäiden geenitoiminnan tutkimiseen.
Banaanikärpäsen kromosomiston erikoisimpia rakenteita ovat sen toukan sylkirauhasten polyteenikromosomit. Ne ovat kaapelimaisia useaan kertaan monistuneita jättiläiskromosomeja. Polyteenikromosomeja tavataan joillakin Diptera-lajeilla kudoksissa, jotka eivät erilaistu aikuisen hyönteisen rakenteiksi. Ne ovat pääosin geenitoimintaa tehostavia rakenteita: useiden identtisten geenikopioiden ansiosta mRNA-synteesi on polyteenikromosomillisissa soluissa erittäin tehokasta. Polytenikromosomeja tavataankin siksi useimmiten sylkirauhasten solujen kaltaisissa solutyypeissä, joissa vaaditaan paljon joitain tiettyä proteiinia.
Kromosomien koko on erittäin suuri tavallisiin interfaasikromosomeihin verrattuna. Ne voivat olla paksuudeltaan jopa 15–25 μm ja pituudeltaan 100–250 μm. Polyteenikromosomien rakenteelle on tyypillistä tummien kromomeeri- ja vaaleiden interkromomeeriraitojen vaihtelu, joiden avulla kromosomit voidaan erottaa toisistaan. Juovarakenne syntyy DNA-rihmojen lukumäärän vaihtelusta ja erilaisesta pakkautumisasteesta kromosomin eri osissa. Kromosomit ovat organisoituneet kromosentrin ympärille, joka sisältää niiden sentromeerialueet.[32]
Banaanikärpäsen geenien, mutaatioiden ja eri kantojen merkintä on hyvin tarkkaan määriteltyä. Nimeämiskäytännöt ja merkintätavat juontavat juurensa jo T. H. Morganin ajalta. Tarkkaan säännelty geneettinen nomenklatuuri helpottaa huomattavasti tutkimuksen tekemistä, sillä se mahdollistaa erilaisten banaanikärpäskantojen yksiselitteisen kuvaamisen.
Banaanikärpäsgenetiikassa geenien nimet ovat yleensä johdettu geenin ensimmäisen havaitun mutantin fenotyypistä. Esimerkiksi white-geenin ensimmäisenä kuvattu mutanttialleeli muuttaa kärpäsen silmät valkoisiksi. Jokaisen geenin normaali- eli villimuotoa merkitään plus-merkillä (+) Geenien nimet merkitään aina kursivoituna. Nimi alkaa pienellä alkukirjaimella, jos em. ensimmäinen tunnettu mutantti on ollut resessiivinen ja isolla, jos se on ollut dominoiva. Jokaisesta geenistä voidaan käyttää myös sen 1–3 -kirjaimista lyhennettä (esimerkiksi white = w; hedgehog = hh tai decapentaplegic = dpp). Geenien tuottamista proteiineista käytetään samoja nimiä, mutta ne kirjoitetaan aina isolla eikä niitä kursivoida (esimerkiksi White, W; Hedgehog, HH tai Decapentaplegic, DPP). Jos geenistä tunnetaan useita mutanttialleeleja, ne merkitään yleensä yläindeksillä. (esimerkiksi wa, ww) Samoin villialleelin merkintää voidaan tarkentaa yläindeksillä (esimerkiksi w+, hh+ tai dpp+).Tämän lisäksi on olemassa lukuisia muita käytäntöjä, jotka mahdollistavat niin monimutkaisten risteytysten kuin myös runsaasti geeni- ja kromosomimutaatioita sisältävien kantojen yksiselitteisen kuvaamisen.[16][33]
Toisinaan jotkut geeneille annetuista nimistä voivat olla varsin erikoisia. Useiden väitöskirjatutkijoiden ja jopa edistyneempienkin banaanikärpästieteilijöiden pyrkimyksenä on nimittäin ollut jo Morganin ajoista lähtien keksiä kuvaamilleen uusille geeneille mahdollisimman "hauska", mutta samalla kuitenkin kuvaava nimi. Tämän pitkän tradition tulosta ovat muun muassa shavenbaby-mutantti, jonka toukat ovat karvattomia ja he-is-not-interested-geeni, joka vaikuttaa koiraiden kosiokäyttäytymiseen.[34]
Koska banaanikärpästen elintavat saavat ne viihtymään erinomaisesti myös ihmisasumuksissa, niiden määrä kodeissa voi joskus kasvaa häiritseväksi. Asuntoihin sisälle tunkeutuvia kärpäsiä pyydystetään rakentamalla tappava kärpäsansa esimerkiksi suppilosta, jonka pohjalla on syöttinä pieni määrä jotakin käynyttä nestettä. Syötti voi olla esimerkiksi olutta, väkiviinaetikkaa tai punaviiniä, joka voi olla etikoitunuttakin. Pyydykseen joutuneet kärpäset eivät pääse suppilosta pois ja hukkuvat sinne. Syöttinesteen joukkoon voi lisätä myös astianpesuainetta. Se alentaa nesteen pintajännitystä ja edesauttaa siten kärpästen hukkumista.[13]
Luonnosta tai kotoa eri tavoin pyydystettyjä tai lemmikkikaupasta ostettuja banaanikärpäsiä käytetään myös esimerkiksi lemmikkisammakoiden ja akvaariokalojen ruokana. Esimerkiksi veden pinnasta ravintonsa hankkiville labyrinttikaloille banaanikärpäset ovat suositeltua ravintoa. Ruokintaan käytetään useimmiten kaupan olevia siivettömiä mutanttikärpäskantoja, sillä ne eivät voi karata lentämällä pois terraariosta tai akvaariosta.[35][36] Banaanikärpäsiä voidaan kasvattaa myös kotona. Kasvatus onnistuu parhaiten erlenmeyer-pullon kaltaisessa lasiastiassa, johon on valettu hiivaa ja fruktoosisokeria sisältävää agaroosi- ja mannaryynihyytelöä.[37]
Lähes vastaavaa banaanikärpästen kasvatusmenetelmää käytetään myös useimmissa laboratorioissa, tosin useimmiten pulloina käytetään tähän tarkoitukseen erityisesti valmistettuja 200 ml:n vetoisia kasvatuspulloja ja 50 ml:n vetoisia risteytyspulloja.[16] Kantoja ylläpidetään yleensä 18 °C:ssa, jossa sukupolvenkierron pituus on noin 4–5 viikkoa. Risteytykset tehdään useimmiten noin 24 °C:ssa, jolloin kierto on nopeampi eikä tuloksia tarvitse odottaa liian pitkään. Kasvatuspulloissa ylläpidettävät kärpäset siirretään uusiin pulloihin noin puolentoista kuukauden välein, jotta kärpäsille on aina tarjolla tuoretta ravintoa eivätkä mahdolliset homeet pääse leviämään ravintoalustassa.[38]
Yksi syy banaanikärpäsen suosioon laboratorio-organismina on myös sen taudin- ja loistenkestävyys. Yleisimmät laboratoriokantojen ongelmista johtuvat joko kasvatusalustassa leviävistä homeista tai punkeista. Viime vuosina useissa laboratorioissa on myös raportoitu esiintyvän pikornaviruksiin kuuluvaa DCV-virusta (engl. Drosophila C Virus), joka tappaa koteloituneita toukkia. Useimpia banaanikärpäsen tauteja torjutaan yksinkertaisesti pitämällä kasvatustilat mahdollisimman puhtaina ja eristämällä kaikki laboratorioon saapuvat uudet kannat.[38]
Banaanikärpänen (Drosophila melanogaster) on pieni kellanruskea mahlakärpäslaji, joka on jo vuosikymmenten ajan ollut yksi kokeellisen biologisen tutkimuksen tärkeimmistä malliorganismeista. Yleiskielessä banaanikärpäsellä voidaan tarkoittaa myös koko mahlakärpästen heimoa tai useita muita Drosophila-suvun lajeja, joista monet ovat Suomessa huomattavasti D. melanogaster -lajia yleisempiä.
Vaikka banaanikärpänen on tavallinen vieras suomalaisissakin kodeissa, se ei pysty talvehtimaan Suomessa vaan kanta on riippuvainen Baltian maista saapuvista ja kauppojen hedelmien mukana tulevista yksilöistä. Ravinnokseen mahlakärpäslajit imevät käymistilassa olevia nesteitä, esimerkiksi hedelmien mehua ja mahlaa. Toukat elävät esimerkiksi mahlassa tai maahan pudonneissa marjoissa ja hedelmissä syöden nesteitä sekä hiivoja ja muita mikro-organismeja.
Banaanikärpäsen biologisella tutkimuksella on pitkä historia. Nykyäänkin se on yksi yleisimmin käytetyistä malliorganismeista, josta on eristetty laboratoriokasvatuksiin tuhansia genotyypiltään erilaisia mutanttikantoja. Lajin yksilöitä käytetäänkin lähes kaikilla biologian osa-alueilla. Erityisesti banaanikärpäsiä käytetään geneettisissä, kehitysbiologisissa ja fysiologisissa tutkimuksissa, joissa voidaan selvittää muun muassa muistin toimintaa tai alkoholin vaikutuksia. Lajin koko genomin emäsjärjestys selvitettiin jo vuonna 2000. Koska ihmisen ja banaanikärpäsen geenitoimintojen on havaittu olevan pohjimmiltaan melko samanlaisia, voidaan kärpäsellä saatuja tuloksia soveltaa usein myös ihmisellä.
Banaanikärpäsen suosioon malliorganismina ovat vaikuttaneet monet seikat, mutta erityisesti sen helppo kasvatettavuus, taudinkestävyys, lyhyt sukupolvenkierto ja mutaatioiden synnyttämisen helppous nostivat sen tutkijoiden suosioon jo 1900-luvun alussa. Nykyään samoja ominaisuuksia käyttävät hyväkseen muun muassa monet matelija- ja akvaarioharrastajat, jotka käyttävät siivettömiä banaanikärpäsen mutanttikantoja lemmikkiensä elävänä ravintona.
Mouche du vinaigre
La drosophile ou mouche du vinaigre (Drosophila melanogaster) est une espèce d'insectes diptères brachycères de la famille des Drosophilidae.
La drosophile mesure quelques millimètres de long et est connue pour pondre dans les fruits. Thomas Hunt Morgan, un embryologiste et généticien américain, était parmi les premiers à étudier sa zoologie et ses variations phénotypiques (Morgan, Bridges et Sturtevant, 1925) ; en 1933, il a reçu le prix Nobel de physiologie ou médecine pour ses découvertes sur le rôle joué par les chromosomes de la drosophile dans l’hérédité[1]. Depuis, cette dernière est devenue l'un des principaux organismes modèles des recherches en génétique et en développement. Son utilisation comme espèce modèle nous permet d’avoir une acquisition de connaissances rapide vu que l’étendue de son génome est connue et qu’elle est facile à manipuler (petite taille, élevage aisé)[2]. De plus, son code génétique et l'organisation de la cellule reflètent ceux de la grande majorité des animaux, incluant les organismes plus complexes, notamment l’Homme[2].
Ainsi, plusieurs autres expériences ayant pour sujet la drosophile ont permis de comprendre la reproduction sexuée, le développement de l'embryon, ou bien encore l’adaptation à l’environnement, chez l’ensemble des Animalia. Entre autres, les études de Hall, Rosbash et Young sur les mécanismes de l’horloge de la drosophile et les gènes impliqués ont reçu le prix Nobel de médecine de 2017[3],[4]. Dans la littérature biologique contemporaine, elle est souvent désignée tout simplement sous le nom de son genre, Drosophila (qui contient pourtant de nombreuses autres espèces).
Drosophila, nom du genre, est une adaptation scientifique moderne du grec δρόσος, drósos, « rosée », + φίλος, phílos, « qui aime »[pourquoi ?]. L'épithète spécifique melanogaster, également tirée du grec, signifie « au ventre noir ».
« Mouche du vinaigre » est l'appellation vernaculaire de l'espèce[5]. Elle renvoie à son attirance pour ce breuvage et pour les matières volatiles issues de la fermentation[6] (en contradiction formelle avec l'adage selon lequel « on n'attrape pas les mouches avec du vinaigre[7] »).
Ces mouches sont de couleur brun jaunâtre, avec des anneaux transversaux noirs sur l'abdomen. Elles ont des yeux rouge vif. Elles présentent un dimorphisme sexuel : les femelles mesurent environ 3 à 4 millimètres de long ; les mâles sont un peu plus petits et la partie arrière de leur corps est plus foncée. Les antennes sont courtes et possèdent une extrémité plumeuse. De plus, cette mouche possède des ailes de taille réduite et d'aspect chiffonné. Pour un néophyte qui essaierait de décrire la différence entre les sexes sous une loupe binoculaire, le caractère distinctif le plus marquant est probablement l'amas de poils pointus entourant l'anus et les parties génitales du mâle. Sur le site web FlyBase, on trouve un grand nombre d'images à ce propos.
Le cycle de vie de Drosophila melanogaster dure environ deux semaines à 22 °C ; le cycle prend deux fois plus de temps à 18 °C. Les femelles pondent environ 400 œufs dans des fruits en putréfaction ou dans d'autres matières organiques. Les œufs ont une longueur d'environ 0,5 millimètre. La larve sort de l'œuf après 24 heures et croît durant cinq jours en muant deux fois, 24 et 48 heures après l'éclosion. Au cours de leur croissance, elles se nourrissent des micro-organismes qui décomposent le fruit, ainsi que des sucres du fruit lui-même. Ensuite, les larves s'encapsulent dans la pupe et subissent une métamorphose qui dure cinq jours, à la suite de laquelle l'adulte émerge.
Les femelles s'accouplent 8 à 12 heures après être sorties de leur pupe (dépendant de la température). Elles stockent le sperme des mâles auxquels elles se sont accouplées pour pouvoir l'utiliser ultérieurement. Pour cette raison, les généticiens doivent capturer les mouches femelles avant leur premier rapport sexuel et s'assurer ainsi qu'elles ne s'accouplent qu'avec le mâle précis requis par l'expérience. Selon le Red Book de Michael Ashburner[réf. souhaitée], les femelles inséminées peuvent être « re-virginisées » par incubation prolongée à −10 °C, ce qui tue le sperme.
Drosophila melanogaster est l'un des organismes modèles les plus étudiés en recherche biologique, en particulier en génétique et en biologie du développement. Il y a plusieurs raisons pour cela :
Le génome des Drosophila contient 4 paires de chromosomes : une paire X/Y, et trois autosomes appelés 2, 3, et 4. Le quatrième chromosome est si minuscule qu'on l'omet souvent. Le génome contient environ 165 millions de bases et environ 13 000 gènes. Le génome a fini d'être séquencé et annoté en 2000[8].
D'un point de vue génétique, les êtres humains et les drosophiles ont des similitudes significatives. Selon une étude de mars 2000 de l'Institut américain de recherche sur le génome humain, environ 60 % des gènes sont conservés entre les deux espèces[9]. Selon une analyse de 2001, 77 % des gènes associés à des maladies humaines identifiées ont un homologue dans le génome de la drosophile[10]. 50 % des protéines de cette mouche ont des analogues chez les mammifères. Drosophila est utilisée comme modèle génétique pour diverses maladies humaines dont la maladie de Parkinson et celle de Huntington.
Le chromosome Y ne définit pas le sexe mâle chez la mouche comme chez l'être humain. C'est le rapport entre le nombre de gènes autosomaux déterminant le caractère mâle et le nombre de gènes femelles portés sur le ou les chromosomes X qui importe. Ainsi une mouche XY peut phénotypiquement être une femelle si la balance entre le nombre de gènes déterminant mâle et femelle penche en faveur du déterminisme femelle[11]. Plus précisément, si le rapport entre le nombre de chromosomes X et le nombre de jeux d'autosomes est supérieur à 1 pour 1, on obtient une mouche femelle. De même, si ce rapport est inférieur ou égal à 0,5 pour 1, on obtient une mouche mâle. Par exemple une mouche diploide (deux jeux d'autosomes) possédant deux chromosomes X est une femelle, alors qu'une mouche diploide possédant un seul chromosome X est un mâle. Il est à noter que certains génotypes particuliers donnent des mouches de phénotype intermédiaire (intersexe) et stériles[12].
Le nom des gènes nommés d'après des allèles récessifs commence par une minuscule, celui des allèles dominants par une majuscule. Les gènes qui doivent leur nom à un dérivé de protéine commencent par une minuscule. Les gènes sont typiquement écrits en italiques. La convention d'écriture des génotypes est :
Dans la communauté de la biologie du développement, les généticiens, travaillant sur des Drosophila nomment les mutations d'après le phénotype observé. Par exemple, l'homologue de Pax 6, qui est important pour la formation de l'œil est appelé eyeless (sans œil) car cette structure est absente chez le mutant. eyeless est donc requis pour la formation de l'œil. Ces noms évoquent directement la fonction des gènes, et sont faciles à mémoriser.
L'horloge circadienne de la drosophile implique plusieurs gènes rythmiques interliés par des boucles de rétroaction pour permettre une régulation étroite. La première boucle implique les gènes Per (Period) et Tim (Timeless) comme facteurs principaux[13]. La transcription de ces deux gènes est activée durant le temps de Zeitgeber de ZT4 à ZT18, lorsque l’hétérodimère formé par les protéines Clock (Circadian Locomotor Output Cycles Kaput) et Cycle (Cyc) se lie à la boîte E de leur promoteur respectif[14],[15],[16]. Le temps de Zeitgeber est en relation avec les cycles lumière / obscurité des horloges circadiennes dans lesquelles ZT0 à ZT12 correspond à la lumière constante et ZT12 à ZT0, à l’obscurité constante[17]. Une fois traduites, les protéines Per et Tim s’associent ensemble pour former un hétérodimère à leur tour[18]. L’accumulation des hétérodimères Per/Tim dans le cytoplasme entraîne sa pénétration à travers la membrane nucléique à environ ZT0[15]. Dans le noyau, elles inhibent la liaison entre les protéines Clk et Cyc, ce qui provoque l’arrêt de la transcription de ses propres gènes[19] [Figure 1]. Cela étant dit, l’expression oscillatoire des protéines de Clk et Cyc est décalée de phase par rapport à l’expression de Per et Tim vu que ces deux couples d’hétérodimères sont interliés par une boucle de rétroaction négative.
En plus de la boucle de rétroaction principale, l’horloge interne est régulée par une boucle de rétroaction secondaire impliquant directement l’hétérodimère Clk/Cyc ainsi que les facteurs de transcription vrille (Vri) et PDP1 (protéine de domaine PAR 1) qui travaillent ensemble afin de créer une oscillation cohérente de l'expression de Clk[20],[21]. Expérimentalement, in vivo, l’absence de Vri dans les cellules rythmiques entraîne une augmentation de la transcription de Clk ce qui résulte, subséquemment, à une surexpression des protéines per et tim[22] ; autrement dit, à l’état sauvage, Vri est un inhibiteur de la transcription de Clk. Par opposition à Vri, Pdp1 est un activateur de la transcription de Clk : en présence de ce facteur de transcription, Clk, ainsi que per et tim, sont surexprimées[23]. L'activation de la transcription de Vri et Pdp1 est directement régulé par le complexe Clk/Cyc, formant, ainsi, une seconde boucle de rétroaction qui régule l’expression rythmique du gène Clk[20] [Figure 2].
Les deux boucles de rétroaction impliquent, toutes deux, l’hétérodimère Clk/Cyc ; ces deux protéines peuvent être considérées comme l’élément central de la régulation du rythme endogène des drosophiles[24] [Figure 2]. Cette relation entre les boucles de régulation de la rythmicité de l’horloge circadienne assure une meilleure stabilité et constance pour maintenir l’homéostasie de l’organisme sous multiples conditions externes.
Le temps circadien est utilisé afin d'interpréter la photopériode afin d'obtenir des résultats qui dépendent de la longueur du jour. Chez la drosophile, la variation de la lumière externe affecte grandement les mécanismes de l’horloge circadienne qui coordonne leurs activités physiologiques. En effet, selon la présence ou l’absence de lumière, le motif d’expression des gènes impliqués et la distribution cellulaire des protéines sont modifiés dans les neurones régulateurs, clock neurons. Durant la journée, la lumière active la protéine Cryptochrome (Cry) qui est directement impliqué dans le processus d’ubiquitination et de dégradation de la protéine Tim de l’hétérodimère Per/Tim[15]. En absence de la protéine Tim, la protéine Per devient sensible à la phosphorylation par la protéine doubletime (DBT). Toutefois cette dernière n'est pas directement responsable de la dégradation de Per. Or, une fois les hétérodimères Per/Tim dégradés, le complexe Clk/Cyc ne reçoit plus de signal d’inhibition et se lie de nouveau au promoteur des gènes Per et Tim[15],[20],[25]. Ainsi, durant le jour, la transcription de ces gènes est continuée, mais les protéines sont systématiquement dégradées par Cry[26] [Figure 3]. L’arrivée de la nuit coïncide avec l’achèvement du signal lumineux, et donc, l’inactivation de Cry. Cela conduit à une accumulation de Per et Tim dans le cytoplasme[15] ; Per et Tim entrent, alors, dans le noyau soit séparément, soit en tant que hétérodimère, et régulent l’expression d’autres gènes[27].
Au niveau de la seconde boucle de rétroaction impliquant Vri et Pdp1ε, les répercussions directes de la lumière sont encore peu connues. Par contre, par l’analyse de Western blot de protéines extraites à différentes périodes de la journée, il est possible de constater qu’elles sont, toutes les deux, transcrites durant la journée et leur concentration chute en obscurité[20] [Figure 4]. Or, vri est dégradé avant Pdp1ε d’une période d’environ 4 heures, ce qui permet de définir le passage de l’activation à la répression de la transcription Clk[20],[24],[28].
Comme la photopériode varie au cours de l’année, la réponse aux signaux environnementaux lumineux permet un mécanisme d’estimation du nombre de jours passés, qui est toutefois peu connu. Il semblerait que lorsqu’un certain seuil de période d’activation ou d’inhibition est atteint par les gènes de l’horloge, les neurosécréteurs émettent un signal endogène responsable de divers mécanismes physiologiques comme le développement ou la diapause[29]. Toutefois, il semblerait que le processus d’éclosion est ne soit pas régulé par le photopériodisme[30]. D’autant plus, des études récentes démontrent que des changements dans la photopériode peuvent même conférer un avantage au niveau de la tolérance du froid. En effet, chez Drosophila Montana, une journée écourtée dicte un signal qui peut permettre une acclimatation au froid anticipée. Il s’agit alors d’une plasticité de tolérance au froid induite par des changements photopériodiques perçus par l’horloge interne[31].
Des horloges moléculaires ont été identifiées dans divers tissus périphériques de la drosophile[32]. Effectivement, des segments corporels dissociés et ensuite cultivés (la tête, le thorax et l'abdomen), marqués avec la protéine fluorescente verte GFP[33], démontre l'autonomie circadienne de ses tissus [Figure 5]. De plus, chaque segment dissocié est rythmique avec la même phase et la même forme d'onde. Cela confirme que l'horloge moléculaire de la drosophile peut fonctionner à un niveau cellulaire et ce de manière autonome. Chaque cellule à une capacité photoréceptrice et peut un certain rythme endogène propre[34]. Précédemment, la tête était considérée comme la coordonnatrice principale de l'horloge moléculaire chez la drosophile mais ces résultats illustrent qu'elle ne coordonne pas tous les rythmes. Il s’agit de la lumière dans ce cas qui a le potentiel d'affecter en même temps toutes les parties du corps et celle-ci sert de signal de coordination principal[33]. Cependant, dire que la lumière est l'unique cause de synchronisation n'est pas tout à fait juste, car il est possible que la température en soit également impliqué. De plus, le comportement alimentaire de la drosophile est sous contrôle des tissus métaboliques qui le régulent de face rythmique. L'horloge moléculaire affecte le stockage d'énergie dans le corps gras de la drosophile. En effet, l'homéostasie énergétique de la drosophile est contrôlée grâce aux horloges neuronales et périphériques qui ont des effets opposés sur le métabolisme du glucose[35]. Bref, il existe des oscillateurs circadiens autonomes présents dans tout le corps et chaque cellule chez la drosophile est capable de supporter leurs propres horloges indépendantes.
L'ovogenèse se déroule dans les ovarioles de la femelle. Les cellules souches germinales se divisent de façon asymétrique pour donner une nouvelle cellule souche et un cystoblaste. Il y a formation d'un syncitium de 16 cystocytes appelé cyste. L'un des cystes se différentie en ovocyte et les 15 autres en cellules nourricières. L'ovocyte migre vers la région postérieure. L'axe antéro-postérieur est donc mis en place avant la fécondation (de même que l'axe dorso-ventral). Des ponts cytoplasmiques relient les cellules, ce qui permet aux cellules nourricières de transférer des ARNm à l'ovocyte. Les cellules folliculaires et nourricières disparaissent avant la fécondation.
La fécondation déclenche des mitoses incomplètes sans ségrégation des noyaux dans des cellules différentes. Il y a formation d'un syncitium. Certains noyaux migrent à l'extrémité postérieure de l'embryon et se cellularisent formant les cellules germinales initiales. La plupart des autres noyaux migrent ensuite à la périphérie de l'embryon et il y a cellularisation, formant un blastoderme. La gastrulation permet aux cellules ventrales formant le mésoderme de rentrer à l'intérieur de l'embryon par invagination puis par délamination. L'endoderme forme le tube digestif par une double invagination, formant deux tubes qui se rejoignent au milieu de l'embryon. Les 14 segments (ou plus précisément les parasegments) se mettent en place.
Un œil composé de drosophile contient 800 unités de vision ou ommatidia, ce qui en fait l'un des plus développés parmi les insectes. Chaque ommatidium contient 8 cellules photoréceptrices (R1-8), des cellules de support, des cellules de pigment, et une cornée. Les drosophiles standard ont des cellules de pigment rougeâtre (causés par les pigments pteridines et ommochromes)[36] qui servent à absorber l'excès de lumière bleue ce qui empêche l'éblouissement de la mouche par la lumière ambiante. Certains gènes de la couleur des yeux régulent le transport vésiculaire des cellules. Les enzymes et autres substances nécessaires à la synthèse des pigments sont donc transportées à la granule du pigment, qui contient les molécules précurseures des pigments.[36]
Les ailes d'une mouche peuvent battre jusqu'à 250 fois par seconde. Les mouches volent par des séquences directes de mouvement alternant avec de rapides rotations appelées saccades. Au cours de ces rotations, une mouche peut effectuer une rotation de 90 degrés en moins de 50 millisecondes.
Mouche du vinaigre
La drosophile ou mouche du vinaigre (Drosophila melanogaster) est une espèce d'insectes diptères brachycères de la famille des Drosophilidae.
La drosophile mesure quelques millimètres de long et est connue pour pondre dans les fruits. Thomas Hunt Morgan, un embryologiste et généticien américain, était parmi les premiers à étudier sa zoologie et ses variations phénotypiques (Morgan, Bridges et Sturtevant, 1925) ; en 1933, il a reçu le prix Nobel de physiologie ou médecine pour ses découvertes sur le rôle joué par les chromosomes de la drosophile dans l’hérédité. Depuis, cette dernière est devenue l'un des principaux organismes modèles des recherches en génétique et en développement. Son utilisation comme espèce modèle nous permet d’avoir une acquisition de connaissances rapide vu que l’étendue de son génome est connue et qu’elle est facile à manipuler (petite taille, élevage aisé). De plus, son code génétique et l'organisation de la cellule reflètent ceux de la grande majorité des animaux, incluant les organismes plus complexes, notamment l’Homme.
Ainsi, plusieurs autres expériences ayant pour sujet la drosophile ont permis de comprendre la reproduction sexuée, le développement de l'embryon, ou bien encore l’adaptation à l’environnement, chez l’ensemble des Animalia. Entre autres, les études de Hall, Rosbash et Young sur les mécanismes de l’horloge de la drosophile et les gènes impliqués ont reçu le prix Nobel de médecine de 2017,. Dans la littérature biologique contemporaine, elle est souvent désignée tout simplement sous le nom de son genre, Drosophila (qui contient pourtant de nombreuses autres espèces).
Drosophila melanogaster é unha especie de díptero (mosca) da familia Drosophilidae. A especie recibe o nome en xeral de mosca da froita ou mosca do vinagre, que tamén reciben outras especies de Drosophila. Desde que Charles W. Woodworth propuxo o uso desta mosca como organismo modelo para realizar estudos científicos, D. melanogaster é amplamente utilizada na investigación biolóxica en estudos de xenética, fisioloxía, patoxénese microbiana e evolución. É un animal moi axeitado para este mester porque é fácil de coidar, ten só catro pares de cromosomas, reprodúcese rapidamente, e pon moitos ovos.[2] O xenoma desta mosca foi totalmente secuenciado e moitos dos seus xenes teñen homólogos no xenoma humano. D. melanogaster é unha praga común nas casas, en restaurantes e outros lugares onde se serve comida.[3]
As moscas que pertencen á familia Tephritidae tamén se poden chamar "moscas da froita", e orixinan pragas na froita de importancia económica (por exemplo, a especie Ceratitis capitata), e non hai que confundilas coas drosófilas. As Tephrítidae aliméntanse de froita en bo estado, mentres que as drosófilas fano de froitas moi maduras ou podres.
As moscas da froita de tipo silvestre ou salvaxe son amarelo-castañas, teñen ollos vermellos ladrillo e aneis negros transversais no abdome. Presentan dimorfismo sexual: as femias miden 2,5 mm de longo e os machos son algo menores coa parte posterior máis escura. Os machos distínguense doadamente das femias polas súas diferenzas de cor, cunha mancha negra distintiva no abdome, menos evidente en moscas novas (ver figura), e polos peites sexuais (que son unha ringleira de pelos escuros no tarso da primeira pata). Ademais, os machos teñen un grupo de pelos espiñentos (para agarar) que rodean as súas partes xenitais utilizadas para agarrarse ás femias durante o apareamento.[4]
A duración da vida de D. melanogaster é duns 30 días a 29 °C, pero rexistráronse duracións de ata 3 meses.
O período de desenvolvemento de D. melanogaster varía coa temperatura, como ocorre con moitas especies ectotérmicas. Os tempos de desenvolvemento máis curtos (de ovo a adulto), de 7 días, teñen lugar a 28 °C.[5][6] Os tempos de desenvolvemento increméntanse a temperaturas máis altas (11 días a 30 °C) debido ao estrés pola calor. En condicións ideais, o tempo de desenvolvemento a 25 °C é de 8,5 días,[5][6][7] mentres que a 18 °C tarda 19 días[5][6] e a 12 °C tarda uns 50 días.[5][6] En condicións de superpoboación no lugar de cría, os tempos de desenvolvemento increméntanse,[8] e as moscas que emerxen dos ovos son máis pequenas.[8][9] As femias poñen uns 400 ovos (embrións), uns cinco de cada vez, en froita podre ou outros materiais axeitados como cogomelos en descomposición e fluxos de zume elaborado. Os ovos, que miden uns 0,5 mm, eclosionan en de 12 a 15 horas (a 25 °C).[5][6] As larvas resultantes crecen durante 4 días (a 25 °C) e fan a muda dúas veces (no 2º e 3º estadio larvario), en aproximadamente de 24 a 48 horas despois de eclosionaren.[5][6] Durante este tempo, aliméntanse dos microorganismos que decompoñen a froita, e dos azucres da froita. Despois as larvas encapsúlanse no pupario e sofren durante catro días unha metamorfose (a 25 °C), despois da cal os adultos emerxen da pupa.[5][6]
As femias son receptivas ao cortexo de 8 a 12 horas despois de emerxeren.[10] As femias presentan uns grupos de neuronas específicos que afectan ao comportamento de copulación e a elección de parella. Un deses grupos situado no cordón nervioso abdominal permite que a femia deteña os movementos do seu corpo para poder copular.[11] A activación destas neuronas induce que a femia cese de moverse e que se oriente cara ao macho para permitirlle que a monte. Se o grupo neuronal é inactivado, a femia permanece en movemento e non copula. Este grupo neuronal pode ser activado por varios sinais químicos, como as feromonas do macho.[11]
A femia da mosca da froita prefire que o sexo teña unha duración curta, pero os machos prefiren unha maior duración.[12] Os machos realizan unha secuencia de cinco patróns de comportamento para cortexaren as femias. Primeiro, os machos oriéntanse mentres producen un son ou "canción" de cortexo estendendo horizontalmente as ás e facéndoas vibrar. Pouco despois, o macho sitúase na parte posterior do abdome da femia nunha postura baixa para dar golpiños e lamber os xenitais da femia. Finalmente, o macho dobra o seu abdome e intenta a copulación. As femias poden rexeitar aos machos apartándose deles, pateándoos e extrudindo o seu ovipositor.[13] A copulación dura de 15 a 20 minutos,[14] durante os cales os machos transfiren á femia uns cantos centos de espermatozoides moi longos (de 1,76 mm) no fluído seminal.[15] As femias almacenan o esperma nun receptáculo tubular e en dúas espermatecas con forma de fungo, onde os espermas de moitos apareamentos compiten por realizar a fertilización. Crese que hai unha precedencia ou prioridade do último macho, pola cal o último macho en aparearse coas femias enxendra aproximadamente o 80% da descendencia da femia. Esta precedencia ocorre polos mecanismos chamados desprazamento e incapacitación.[16] O desprazamento atribúese ao manexo do esperma pola femia a medida que se producen os diversos apareamentos e é máis significativo durante os primeiros 1 ou 2 días despois da copulación. O desprazamento desde o receptáculo seminal é máis significativo que o desprazamento desde a espermateca.[16] A incapacitación do esperma do primeiro macho polo esperma do segundo macho é significativo de 2 a 7 días despois da copulación. Crese que o responsable deste mecanismo de incapacitación é o fluído seminal do segundo macho (sen retirar o esperma do primeiro macho), que se produce antes da fertilización.[16] O atraso na efectividade do mecanismo de incapacitación crese que é un mecanismo protector que impide que o macho incapacite o seu propio esperma en caso de que este se aparee coa mesma femia repetidamente. As neuronas sensoriais no útero da femia de D. melanogaster responden á proteína do macho chamada péptido sexual, que se encontra no esperma.[11] Esta proteína fai que a femia sexa reticente a copular durante 10 días despois da inseminación. Coñécese a vía de sinalización que leva a este cambio de comportamento. O sinal envíase á rexión do cerebro que é homóloga do hipotálamo e o hipotálamo despois controla o comportamento e desexo sexual.[11]
D. melanogaster utilízase con frecuencia en estudos sobre o aumento da duración da vida. Estes iniciáronse en 1980, ano en que Michael R. Rose realizou un estudo revolucionario en evolución experimental orixinando as moscas "Methuselah" (Metuxalén, nome o patriarca bíblico que se di viviu 969 anos) que teñen unha duración da vida o dobre do normal. Máis recentemente, identificáronse certos xenes como o INDY, que se afirma que incrementan a duración da vida cando están mutados.
Con comportamento referímonos ás accións que un organismo podería realizar en resposta a varios estímulos externos ou internos. Os cambios no comportamento poden indicar unha aprendizaxe, a cal se produce cando un organismo se adapta a unha situación ou fenómeno ao cambiar unha resposta de comportamento determinada. A aprendizaxe está xeralmente asociada co incremento de eficcia biolóxica ou fitness, especialmente cando o comportamento adaptado é un aspecto do comportamento sexual. Os machos de D. melanogaster mostran unha forte curva de aprendizaxe reprodutiva, xa que coa experiencia sexual tenden a modificar o seu futuro comportamento reprodutivo de moitos xeitos. Entre estes cambios están o incremento da selectividade de realizar o cortexo só intraespecificamente (coa súa propia especie), e a diminución do tempo de cortexo. Os machos de D. melanogaster sexualmente virxes sábese que dedican un tempo significativo ao cortexo interespecífico, por exemplo con moscas da especie D. simulans. Os machos de D. melanogaster virxes intentan cortexar femias que aínda non son sexualmente maduras e a outros machos. Os machos de D. melanogaster mostran pouca ou ningunha preferencia polas femias de D. melanogaster en comparación con femias doutras especies ou mesmo con machos. Porén, unha vez que as femias de D. simulans ou outras moscas incapaces de copular con eles rexeitan os intentos dos machos, é moito menos probable que D. melanogaster perda o seu tempo cortexando a outras especies no futuro. Esta aparente modificación do comportamento aprendida parece ser evolutivamente significativa, xa que permite aos machos evitar investir enerxía en encontros sexuais inútiles.[17]
Ademais, os machos con experiencias sexuais previas modifican a súa danza de cortexo cando intentan aparearse con novas femias, e os machos experimentados dedican menos tempo a cortexar, e, por tanto, teñen menores latencias de apareamento, o que significa que poden reproducirse máis rapidamente. Esta diminución da latencia de apareamento orixina unha maior eficacia de apareamento para os machos experimentados en relación cos machos virxes.[18] Esta modificación tamén parece ter vantaxes evolutivas obvias, xa que o incremento da eficacia do apareamento é moi importante na selección natural.
Drosophila melanogaster foi un dos primeiros organismos utilizados para a análise xenética, e hoxe é un dos máis utilizados e mellor coñecidos xeneticamente entre os eucariotas. Todos os organismos utilizan sistemas xenéticos comúns; por tanto, procesos xerais como a transcrición e a replicación do ADN na mosca da froita axudan a comprender estes procesos noutros eucariotas, incluíndo os humanos.[19]
Considérase que Charles W. Woodworth foi o primeiro en criar as Drosophila en suficientes cantidades como para suxerir a W. E. Castle que poderían utilizarse para a investigación xenética durante o seu período na Universidade Harvard.
Thomas Hunt Morgan empezou a utilizar as moscas da froita de forma xeneralizada en estudos experimentais da herdanza na Universidade de Columbia en 1910. O seu laboratorio empezou a coñecerse como o Cuarto das Moscas, situado nun último piso. Este cuarto estaba ocupado por oito mesas, nas que estaban os estudantes facendo os seus experimentos. No Cuarto das Moscas realizáronse algúns dos experimentos máis importantes da historia da bioloxía. Morgan e os seus estudantes finalmente esclareceron moitos principios básicos da herdanza, como a herdanza ligada ao sexo, a epistase, o alelismo múltiple, o ligamento xenético e o mapado de xenes.[19] Os primeiros mapas dos cromosomas de Drosophila foron completados por Alfred Sturtevant.
Drosophila melanogaster é un dos organismos máis estudados na investigación biolóxica, e especialmente en xenética e bioloxía do desenvolvemento. Hai varias razóns para que sexa así:
Os marcadores xenéticos utilízanse comunmente na investigación en Drosophila, por exemplo en cromosomas balanceadores ou insercións de elementos P, e a maioría dos fenotipos son doadamente identificables a simple vista ou co microscopio. Na lista de exemplos de marcadores comúns de máis abaixo, o símbolo do alelo (en inglés) vai seguido polo nome dos xenes afectados e a descrición do seu fenotipo. (Nota: Os alelos recesivos escríbense en minúscula, mentres que os alelos dominantes van en maiúscula.)
Os xenes de Drosophila denomínanse tradicionalmente polo fenotipo que causan cando están mutados. Por exemplo, a ausencia dun determinado xene en Drosophila orixinará un embrión mutante que non desenvolve o corazón. Os científicos chmáronlle tinman (home de folla de lata, polo personaxe do Mago de Oz, que non tiña corazón).[21] Este sistema de nomenclatura comprende un maior número de nomes de xenes que noutros organismos.
O xenoma de D. melanogaster (secuenciado en 2000, e conservado na base de datos FlyBase[20]) contén catro pares de cromosomas: un par X/Y, e tres pares de autosomas numerados 2, 3 e 4. O cuarto cromosoma é tan pequeno (puntiforme) que moitas veces é ignorado, aínda que contén o importante xene eyeless. O xenoma secuenciado de D. melanogaster ten 139,5 millóns de pares de bases, foi anotado[22] e contén aproximadamente 15.682 xenes segundo a edición 73 de Ensembl. Máis do 60% deste xenoma parece ser ADN que non codifica proteínas funcionais[23] implicado no control da expresión xenética. A determinación do sexo en Drosophila ten lugar pola proporción X:A entre os cromosomas X e os autosomas, e non pola presenza dun cromosoma Y como na determinación do sexo en humanos. Aínda que o cromosoma Y de drosófila é enteiramente heterocromático, contén polo menos 16 xenes, moitos dos cales crese que teñen funcións relacionadas co macho.[24]
Un 75% dos xenes humanos coñecidos relacionados con doenzas teñen un xene correspondente no xenoma da mosca da froita,[25] e o 50% das secuencias das proteínas desta mosca teñen homólogos nos mamíferos. Pódese utilizar a base de datos Homophila para procurar homólogos na mosca de xenes humanos causantes de enfermidades e viceversa.[26] Drosophila utilízase como modelo xenético para varias enfermidades humanas como en trastornos neurodexenerativos como as enfermidades de Parkinson, Huntington, ataxia espiñocerebelosa e enfermidade de Alzheimer. Tamén se utiliza esta mosca para estudar os mecanismos que subxacen no envellecemento e estrés oxidativo, inmunidade, diabetes, e cancro, e o abuso de drogas.
A embrioxénese de Drosophila foi exhaustivamente estudada, xa que polo seu pequeno tamaño, curto tempo de xeración, e numerosa descendencia fai que sexa ideal para estudos xenéticos e embriolóxicos. Tamén ten a característica única entre os organismos modelo de que a segmentación do ovo ocorre nun sincitio.
Durante a ovoxénese, unhas pontes citoplasmáticas chamadas "canles de anel" conectan o ovocito en formación a células coidadoras. Os nutrientes e as moléculas que controlan o desenvolvemento móvense desde ditas células ao interior do ovocito. Na figura da esquerda, o ovocito en formación está cuberto de células foliculares de sustentación.
Despois da fertilización do ovocito o embrión temperán (ou embrión sincicial) sofre unha rápida replicación do ADN e prodúcense 13 divisións nucleares ata que se acumulan aproximadamente de 5000 a 6000 núcleos no citoplasma común indiviso do embrión. Ao final da 8ª división a maioría dos núcleos migraron á superficie, rodeando o saco de xema (deixando atrás só uns poucos núcleos, os cales se converterán en núcleos da xema). Despois da 10ª división fórmanse as células polares no extremo posterior do embrión, segregando a liña xerminal do sincitio. Finalmente, despois da 13ª división as membranas celulares invaxínanse lentamente, dividindo o sincitio en células somáticas individualizadas. Unha vez que se completa este proceso comeza a gastrulación.[27]
A división nuclear no embrión temperán de Drosophila ocorre tan rapidamente que non hai verdadeiros puntos de comprobación, polo que poden ocorrer erros na división do ADN. Para solucionar este problema, os núcleos nos que se cometeu algún erro sepáranse dos seus centrosomas e caen ao centro do embrión (o saco da xema), o cal non formará parte da mosca.
A rede de xenes (transcricional e de interacción de proteínas) que dirixe o desenvolvemento temperán do embrión da mosca da froita é unha das mellor coñecidas actualmente, especialmente os patróns ao longo dos eixes anteroposterior (AP) e dorsoventral (DV).[27]
O embrión sofre movementos morfoxenéticos ben caracteriszados durante a gastrulación e o desenvolvemento temperán, como a extensión da banda xerminal, a formación de varios sucos, a invaxinación ventral do mesoderma, invaxinación posterior e anterior do endoderma (tubo dixestivo), e unha segmentación extensa do corpo ata que finalmente eclosiona saíndo da cutícula que o rodea e pasa ao 1º estadio larvario.
Durante o desenvolvemento larvario, os tecidos chamados discos imaxinais crecen dentro da larva. Os discos imaxinais desenvólvense para formar a maioría das estruturas do corpo adulto, como a cabeza, patas, ás, tórax e xenitais. As células dos discos imaxinais quedan aparcadas ou detidas momentaneamente durante a embrioxénese pero continúan crecendo e dividíndose durante os estadios larvarios, a diferenza da maioría das outras células da larva, que se diferenciaron para realizar funcións especializadas e crecen ser experimentar máis divisións celulares. Na metamorfose, a larva forma unha pupa, dentro da cal os tecidos larvarios reabsórbense e os tecidos imaxinais experimentan amplos movementos morfoxenéticos para formar as estruturas adultas.
A drosófila ten cromosomas X e Y e autosomas. A diferenza dos humanos, o cromosoma Y non confire masculinidade, senón que codifica xenes necesarios para producir o esperma. O sexo está determinado pola proporción entre autosomas e cromosomas X. Ademais, cada célula "decide" se vai ser masculina ou feminina independentemente do resto do organismo, o que ten como resultado que ocasionalmente se orixinen individuos xinandromorfos.
Na determinación do sexo de drosófila están implicados tres xenes, chamados sex-lethal, sisterless e deadpan. O xene deadpan é un xene autosómico que inhibe a sex-lethal, mentres que sisterless está situado no cromosoma X e inhibe a acción de deadpan. Unha célula AAX ten dobre dose do xene deadpan ca de sisterless e deste modo sex-lethal queda inhibido e orixínase un macho. Por outra parte, unha célula AAXX terá sisterless dabondo como para inhibir a acción de deadpan, o que permite que o xene sex-lethal se transcriba e orixine unha femia.
Posteriormente, o control por deadpan e sisterless desaparece e o que pasa a ser importante é a forma do xene sex-lethal. A transcrición é causada por un promotor secundario tanto en machos coma en femias. A análise do ADNc mostrou que se expresan diferentes formas en machos e en femias. Sex-lethal afecta ao splicing do seu propio ARNm. Nos machos o 3º exón inclúese no transcrito, o cal codifica un codón de parada que orixina unha forma truncada da proteína. Na versión das femias, a presenza de sex-lethal causa que este exón se perda e prodúcese unha cadea peptídica completa con 7 aminoácidos máis, o que supón unha diferenza entre machos e femias.[28]
A presenza ou ausencia das proteínas funcionais Sex-lethal afectan á transcrición doutra proteína chamada Doublesex. En ausencia de Sex-lethal, Doublesex carecerá do seu 4º exón e será traducida ata incluír o 6º exón (DSX-M[acho]), mentres que en presenza de Sex-lethal o mencionado 4º exón será incluído; este exón codifica un codón de parada e producirá unha versión truncada da proteína (DSX-F[emia]). DSX-F causa a transcrición das proteínas Yolk 1 e 2 nas células somáticas, as cales son bombeadas ao interior do ovocito.
A diferenza dos mamíferos, a drosófila só ten inmunidade innata e carece de resposta inmunitaria adaptativa. O sistema inmunitario de D. melanogaster pode realizar dúas respostas: humoral e mediada por células. A primeira é unha resposta sistémica mediada por medio do xene Toll e a vía imd, que son sistemas paralelos para detectar microbios. A vía Toll en drosófila é homóloga ás vías de tipo Toll dos mamíferos. A proteína Spatzle é un ligando da vía Toll das moscas, que se produce en resposta a bacterias grampositivas, parasitos, e infeccións fúnxicas. Despois da infección, a proteína precursora pro-Spatzle é clivada pola protease SPE (encima procesador de Spatzle) e orixina a Spatzle activa, a cal despois se une ao receptor Toll localizado na superficie celular (no corpo graxo e hemocitos) e dimerízase para activar as vías de sinalización NF-κB de augas abaixo. Por outra parte, a vía imd desencadéase pola presenza de bacterias Gram-negativaa por medio de receptores de superficie (PGRP-LR) e solubles (LC). D. melanogaster ten un "corpo graxo" que se cre que é o homólogo do fígado humano, e é o principal órgano secretor e produce péptidos antimicrobianos. Estes péptidos segréganse á hemolinfa e únense ás bacterias infecciosas, matándoas ao formarlles poros na súa parede celular. Ademais do corpo graxo, os hemocitos, que son as células sanguíneas de drosófila, son os homólogos dos monocitos/macrófagos de mamíferos, e teñen un papel significativo nas respostas inmunes. En resposta aos desafíos inmunitarios, os hemocitos poden segregar citocinas, por exemplo Spatzle, para activar vías de sinalización augas abaixo no corpo graxo. Porén, o mecanismo aínda non está aclarado.
En 1971, Ron Konopka e Seymour Benzer publicou o artigo "Clock mutants of Drosophila melanogaster", no cal describía as primeiras mutacións coñecidas que afectaban ao comportamento dun animal. As moscas de tipo salvaxe mostraban un ritmo de actividade cunha frecuencia de aproximadamente 24 horas. Atoparon que os mutantes con ritmos máis rápidos e máis lentos e tamén as moscas cos seus ritmos alterados que se moven e descansan en arranques repentinos aleatorios. O traballo realizado nos seguintes 30 anos mostra que estas mutacións (e outras) afectan a un grupo de xenes e aos seus produtos que participan nun reloxo biolóxico ou bioquímico. Este reloxo encóntrase nunha ampla gama de células de mosca, pero as células que levan este reloxo que controlan a actividade son varias docenas de neuronas do cerebro central da mosca.
Desde entón, Benzer e outros illaron os xenes implicados na visión, olfacto, audición, aprendizaxe/memoria, cortexo, dor e outros procesos, como a lonxevidade.
Os primeiros mutantes da memoria e aprendizaxe (dunce, rutabaga etc.) foron illados por William Quinn mentres estaba no laboratorio de Benzer, e codificaban compoñentes dunha vía de sinalización celular na que interviña o AMP cíclico, a proteína quinase A e un factor de transcrición chamado CREB. Estas moléculas están tamén implicadas na plasticidade sináptica no molusco Aplysia e en mamíferos.
As moscas macho interpretan unha "canción" para as femias durante o cortexo usando as súas ás para xerar o son, e algunhas características xenéticas do comportamento sexual xa foron caracterizadas. En particular, o xene fruitless ten varias formas de splicing, e as moscas macho que expresan formas de splicing que serían propias das femias teñen un comportamento similar ao das femias e viceversa. As canles TRP nompC, nanchung, e inactive exprésanse en neuronas do órgano de Johnston sensitivo e participan na transdución do son.[29][30]
Ademais, Drosophila foi utilizada en investigacións neurofarmacolóxicas, como estudos sobre o consumo de cocaína e alcohol.
O ollo composto da mosca da froita contén 760 ollos unitarios ou omatidios, e son uns dos máis avanzados entre os insectos. Cada omatidio contén 8 células fotorreceptoras (R1-8), células de apoio, células pigmentarias, e unha córnea. As moscas de tipo salvaxe teñen células pigmentarias avermelladas, que serven para absorber o exceso de luz azul para que a mosca non quede cegada pola luz ambiental.
Cada célula fotorreceptora consta de dúas seccións principais, o corpo celular e o rabdómero. O corpo celular contén o núcleo celular e o rabdómero, de 100 μm de longo, está feito de membranas amoreadas que semellan un cepillo de dentes chamadas microvilosidades. Cada microvilosidade mide 1 ou 2 μm de longo e ~60 nm de diámetro.[31] A membrana do rabdómero está ateigada de moléculas de rodopsina, uns 100 millóns, que é a proteína visual que absorbe a luz. O resto das proteínas visuais están tamén apertadamente empaquetadas no espazo das microvilosidades, deixando moi pouco espazo para o citoplasma.
Os fotorreceptores de Drosophila expresan varias isoformas da rodopsina. As células fotorreceptoras R1-R6 expresan a rodopsina 1 (Rh1), que absorbe a luz azul (de 480 nm). As células R7 e R8 poden expresar ou ben unha combinación de Rh3 e Rh4, que absorben a luz ultravioleta (de 345 nm e 375 nm), ou ben de Rh5 e Rh6, que absorben a luz azul (de 437 nm) e verde (de 508 nm), respectivamente. Cada molécula de rodopsina consta dunha proteína opsina unida covalentemente a un cromóforo carotenoide chamado 11-cis-3-hidroxirretinal.[32]
Igual ca na visión dos vertebrados, a transdución visual en invertebrados ten lugar por medio dunha vía acoplada á proteína G. Porén, en vertebrados a proteína G empregada é a transducina, mentres que en invertebrados é a Gq (dgq en Drosophila). Cando a rodopsina (Rh) absorbe un fotón de luz, o seu cromóforo, o 11-cis-3-hidroxirretinal, é isomerizado a todo-trans-3-hidroxirretinal. A rodopsina sofre un cambio conformacional pasando á súa forma activa, a metarrodopsina. A metarrodopsina activa a Gq, a cal á súa vez activa unha fosfolipase Cβ (PLCβ) chamada NorpA.[33]
PLCβ hidroliza o fosfatidilinositol (4,5)-bisfosfato (PIP2), que é un fosfolípido que se encontra na membrana plasmática, orixinando inositol trisfosfato (IP3) soluble e diacilglicerol (DAG), que permanece na membrana. O DAG (ou un derivado do DAG) causa que se abra un canle iónica selectiva para o calcio chamado TRP (potencial receptor transitorio) e o calcio e o sodio flúen ao interior da célula. O IP3 crese que se une ao receptores do IP3 nas cisternas subrabdoméricas, que son unha extensión do retículo endoplasmático, e causan a liberación de calcio, pero este proceso non parece ser esencial para unha visión normal.[33]
O calcio únese a proteínas como a calmodulina (CaM) e a unha proteína quinase C (PKC) específica do ollo denominada InaC. Estas proteínas interaccionan con outras proteínas e son necesarias para cortar a resposta á luz. Ademais, unhas proteínas chamadas arrestinas únense á metarrodopsina e impiden que esta active a máis Gq. Un intercambiador sodio-calcio chamado CalX bombea o calcio fóra da célula, utilizando o gradiente de sodio cara ao interior para exportar calcio cunha estequiometría de 3 Na+/ 1 Ca++.[34]
O TRP, a InaC, e a PLC forman un complexo de sinalización ao unirse a unha proteína armazón chamada InaD. A InaD contén cinco dominios de unión (dominios PDZ), que se unen especificamente ao C-terminal das proteínas diana. A alteración deste complexo por mutacións nos dominios PDZ ou nas proteínas diana reduce a eficiencia da sinalización. Por exemplo, a alteración da interacción entre a InaC, a proteína quinase C, e a InaD orixina un atraso na inactivación da resposta á luz.
A diferenza da metarrodopsina de vertebrados, a metarrodopsina de invertebrados pode converterse de novo en rodopsina ao absorber un fotón de luz laranxa (de 580 nm).
Aproximadamente 2/3 do cerebro de Drosophila están dedicados ao procesamento visual.[35] Aínda que a resolución espacial da súa visión é significativamente peor ca a humana, a súa resolución temporal é aproximadamente dez veces mellor.
As ás dunha mosca poden bater ata 220 veces por segundo. As moscas voan seguindo secuencias de movemento en liña recta intercaladas con rápidos xiros. Durante estes xiros unha mosca pode rotar 90 graos en menos de 50 milisegundos.
Pensábase antes que as características do voo de drosófila estaban dominadas pola viscosidade do aire, en vez de pola inercia do corpo da mosca. Esta idea foi posta en dúbida polas investigacións realizadas no laboratorio de Michael Dickinson, que indicaban que as moscas realizaban xiros, nos que a mosca acelera, frea mentres xira, e acelera outra vez ao final do xiro, o que suxire que a inercia é a forza dominante, igual que no caso dos animais voadores grandes.[36][37] Porén, os trabllos seguintes indicaron que aínda que os efectos viscosos sobre o corpo do insecto durante o voo poden ser desprezables, as forzas aerodinámicas nas ás son as que en realidade fan que os xiros da mosca da froita sexan diminuídos pola viscosidade do aire.[38]
Drosophila é xeralmente considerada unha praga ou polo menos unha molestia debido á súa tendencia a infestar casas e establecementos nos que hai froitas; as moscas poden concentrarse en casas, restaurantes, almacéns e outros lugares.[3] A eliminación dunha infestación pode ser difícil, xa que as larvas poden seguir eclosionando nas froitas almacenadas mesmo se a poboación adulta foi xa eliminada.
Drosophila melanogaster é unha especie de díptero (mosca) da familia Drosophilidae. A especie recibe o nome en xeral de mosca da froita ou mosca do vinagre, que tamén reciben outras especies de Drosophila. Desde que Charles W. Woodworth propuxo o uso desta mosca como organismo modelo para realizar estudos científicos, D. melanogaster é amplamente utilizada na investigación biolóxica en estudos de xenética, fisioloxía, patoxénese microbiana e evolución. É un animal moi axeitado para este mester porque é fácil de coidar, ten só catro pares de cromosomas, reprodúcese rapidamente, e pon moitos ovos. O xenoma desta mosca foi totalmente secuenciado e moitos dos seus xenes teñen homólogos no xenoma humano. D. melanogaster é unha praga común nas casas, en restaurantes e outros lugares onde se serve comida.
As moscas que pertencen á familia Tephritidae tamén se poden chamar "moscas da froita", e orixinan pragas na froita de importancia económica (por exemplo, a especie Ceratitis capitata), e non hai que confundilas coas drosófilas. As Tephrítidae aliméntanse de froita en bo estado, mentres que as drosófilas fano de froitas moi maduras ou podres.
Vinska mušica (lat. Drosophila melanogaster) je kukac iz reda dvokrilaca.
Postoji mnogo drugih vrsta voćnih mušica, ali vinska mušica daleko je najpoznatija, jer se često koristi za laboratorijske pokuse posebice mutacijske i genetičke pokuse. Jedan od razloga za to je brz rast i razmnožavanje. Vrijeme jedne generacije je oko 14 dana u laboratorijskim uvjetima (vrijeme jedne generacije čovjeka je oko 20 godina). Svaka ženka može proizvesti nekoliko stotina potomaka. Još jedna prednost uzgoja je lako razlikovanje mužjaka i ženki. Naime, mužjak ima crni zadak i dvije-tri vodoravne pruge na leđima dok ženka ima svijetli obli zadak i pet-šest vodoravnih pruga na leđima. Ima osam kromosoma (2n).
Vinska mušica duga je 3 do 4 mm. Živi od živih stanica kvasca uglavnom iz truljenja voća i povrća. U samo dva tjedna, odvija se proces razvoja jajašca u ličinku, ličinke u kukuljicu, iz koje se razvije odrasla jedinka.
U žlijezdama slinovnicama vinske mušice mogu se naći neobičajeno veliki kromosomi. Nakon bojenja, oni su dobro vidljivi pod svjetlosnim mikroskopom. Zbog toga je vinska mušica gotovo idealna za genetska istraživanja pogotova za istraživanja mutacija. Danas postoji na tisuće mutanata vinskih mušica. Npr. mutirana vinska mušica može imati tupa krila (nesimetrična) umjesto normalnih krila, tamnu kožu umjesto žuto-smeđe kože i bijele oči umjesto crvenih očiju.
Charles W. Woodworth na prijedlog William E. Castlea smatra se prvim koji je uzgajao vinske mušice za znanstvena istraživanja. Time se ozbiljnije počeo baviti Thomas Hunt Morgan 1910. godine. Za vrijeme boravka na sveučilštu Columbia, Morgan je uspio pokazati kako se geni prenose na kromosomima i da su mehanička osnova nasljeđivanja. Time je postavio osnove za razvoj moderne genetike. Godine 1933. dobio je Nobelovu nagradu za fiziologiju ili medicinu.
Drosophila melanogaster adalah jenis serangga bersayap yang masuk ke dalam ordo Diptera, (bangsa lalat).
Spesies ini umumnya dikenal sebagai lalat buah dalam pustaka-pustaka biologi eksperimental (walaupun banyak jenis lalat-lalat buah lainnya) dan merupakan organisme model yang paling banyak digunakan dalam penelitian genetika, fisiologi dan evolusi sejarah kehidupan. D. melanogaster populer karena sangat mudah berbiak (hanya memerlukan waktu dua minggu untuk menyelesaikan seluruh daur kehidupannya), mudah pemeliharaannya, serta memiliki banyak variasi fenotipe yang relatif mudah diamati.
Drosophila melanogaster adalah jenis serangga bersayap yang masuk ke dalam ordo Diptera, (bangsa lalat).
Spesies ini umumnya dikenal sebagai lalat buah dalam pustaka-pustaka biologi eksperimental (walaupun banyak jenis lalat-lalat buah lainnya) dan merupakan organisme model yang paling banyak digunakan dalam penelitian genetika, fisiologi dan evolusi sejarah kehidupan. D. melanogaster populer karena sangat mudah berbiak (hanya memerlukan waktu dua minggu untuk menyelesaikan seluruh daur kehidupannya), mudah pemeliharaannya, serta memiliki banyak variasi fenotipe yang relatif mudah diamati.
Ávaxtafluga (fræðiheiti: Drosophila melanogaster) er skordýr af geirflugnaætt.
Ávaxtaflugur eru með rauð augu og gulbrúnar á lit með svarta hringi. Kvendýrin eru um 2.5 mm löng og karldýrin eru örlítið minni og bak þeirra er dekkra. Auðvelt er að kyngreina ávaxtaflugur á litamun.
Þroski ávaxtaflugu ræðst af hitastigi. Þroski (egg til fullvaxta flugu) tekur skemmstan tíma eða 7 daga við 28 °C. Þroski tekur lengri tíma við hærra hitastig (30 °C, 11 daga) vegna streitu við svo háan hita. Bestu skilyrðin eru við 25 °C 8,5 daga, við 18 °C tekur þroskinn 19 daga. Þroskatíminn lengist ef mergð flugna er mikil. Kvendýr verpa 400 eggjum, um fimm í einu inn í rotnandi ávöxt eða aðra hentuga staði t.d. rotnandi sveppi. Eggin sem eru um 0,5 mm löng klekjast út eftir 12-15 klukkustundir (við 25 °C). Lirfran vex í 4 daga (við 25 °C) og nærist á meðan á örverum sem valda rotnun ávaxtarins sem og af sykri hans. Lirfan púpar sig og eftir fjóra daga (við 25 °C) koma fullorðnar flugur úr púpunum.
Kvendýrin verða frjó um 8 - 12 klukkustundum eftir að þær skríða úr púpu.
Ávaxtaflugan er sú lífvera sem mest hefur verið rannsökuð. Ástæður eru þessar:
Ávaxtafluga (fræðiheiti: Drosophila melanogaster) er skordýr af geirflugnaætt.
La drosofila, o moscerino della frutta, (Drosophila (Sophophora) melanogaster Meigen, 1830) è un insetto dell'ordine dei Diptera. Si tratta di un organismo modello per la ricerca scientifica, in quanto è facilmente manipolabile e con un breve ciclo vitale.
Le drosofile hanno degli occhi composti di color rosso mattone. Questo colore deriva dalla presenza di 2 pigmenti: Xantommatina di color marrone e Drosopterina, rossa[1]. Il corpo è giallo-marrone con alcuni anelli neri trasversali sull'addome, da questi anelli deriva il nome scientifico melanogaster (dal greco "melanos", nero e "gaster", ventre). È evidente il dimorfismo sessuale: le femmine sono lunghe 2,5 mm, mentre i maschi sono un po' più corti e la parte terminale del loro corpo è più scura. La principale differenza tra i due sessi (facilmente osservabile al microscopio) è il ciuffo di piccoli peli che circonda l'ano e i genitali del maschio.
Se un organismo di Drosophila melanogaster è tenuto in condizioni ottimali a 25 °C, questo riesce a sopravvivere per circa 50 giorni dallo stadio di uovo sino alla morte[2]. Il ciclo vitale invece, è di circa 10-12 giorni; 22-24 se si pone la drosofila a 18 °C[3]. Le femmine possono deporre fino a 600 uova nell'arco della loro vita, all'interno di frutta o altri materiali organici. Le uova, il cui diametro è di circa 0,5 millimetri, sono cellule aploidi mononucleate.
Il liquido seminale maschile ha due effetti sulla femmina: il primo è regolarizzare la percentuale di uova deposte; il secondo è abbassare il desiderio sessuale nella femmina e prevenire così eventualmente l'accoppiamento con un altro maschio. Ciò nonostante, lo stesso sperma contribuisce anche a minare la salute della femmina abbassandone la durata della vita[4].
Le uova feconde diploidi completano lo sviluppo embrionale nell'arco di sole 24 ore e si schiudono immediatamente dopo. Le larve risultanti crescono per 5-6 giorni[3], usando microorganismi che decompongono la frutta e gli zuccheri della frutta stessa per nutrirsi. Alla fine di questo periodo le larve si trasformano in pupe e, dopo circa 4 giorni, effettuano la metamorfosi, alla fine della quale emergono gli insetti adulti[3].
Le femmine si accoppiano dopo circa 12 ore dalla metamorfosi, accumulando lo sperma in alcune sacche per utilizzarlo a posteriori per fecondare le uova. I genetisti devono, quindi, separare le femmine dal resto della popolazione prima che abbiano la possibilità di accoppiarsi, in modo da essere certi che l'incrocio avvenga solo con il particolare tipo di maschio da utilizzare nell'esperimento. Femmine inseminate possono essere "re-verginizzate" con una prolungata incubazione a -10 °C, uccidendo lo sperma (Ashburner et al. 2005).
La Drosophila melanogaster è un organismo modello, ovvero uno degli organismi più studiati nella ricerca biologica, in particolare nella genetica. I motivi sono molteplici:
A Charles W. Woodworth è riconosciuto il merito di essere stato il primo ad allevare esemplari di Drosophila e di aver suggerito a W. E. Castle, durante il suo soggiorno alla Harvard University, che essi potevano essere usati per ricerche genetiche.
A partire dal 1910 i moscerini della frutta furono di aiuto a Thomas Hunt Morgan per compiere i suoi studi sull'ereditarietà. Morgan e colleghi estesero il lavoro di Mendel descrivendo i meccanismi ereditari legati al cromosoma X e dimostrando che i geni collocati su uno stesso cromosoma non mostravano ricombinazioni genetiche. Gli studi sulle caratteristiche collegate al cromosoma X hanno aiutato a confermare che i geni si trovano nei cromosomi, mentre altri studi sulle caratteristiche morfologiche di Drosophila hanno portato alle prime mappe che mostravano le locazioni dei geni sui cromosomi. La prima mappatura dei cromosomi di Drosophila fu completata da Alfred Sturtevant.
La Drosophila ha 4 paia di cromosomi: una coppia X/Y e tre coppie autosomiche etichettate 2, 3, e 4. Il quarto cromosoma è così sottile che è spesso ignorato. Il genoma, che è stato interamente sequenziato, contiene 132 milioni di basi e approssimativamente 13.767 geni, tra questi ad esempio vi sono:
Da un punto di vista genetico l'uomo e il moscerino della frutta sono abbastanza simili. Circa il 60% delle malattie genetiche conosciute si possono verificare nel patrimonio genetico del moscerino, e circa il 50% delle proteine della Drosophila hanno un analogo nei mammiferi. La Drosophila viene usata come modello genetico per varie malattie umane, inclusi i disturbi neurodegenerativi come la malattia di Parkinson, la corea di Huntington e la malattia di Alzheimer. La mosca viene utilizzata anche per studiare il meccanismo biologico del sistema immunitario, del diabete, del cancro, dell'intelligenza, dell'invecchiamento e persino dell'abuso di sostanze stupefacenti.
I geni che prendono il nome da alleli recessivi hanno l'iniziale minuscola, mentre gli alleli dominanti hanno l'iniziale maiuscola. I geni che prendono il nome dalla proteina prodotta hanno l'iniziale maiuscola. I nomi dei geni sono solitamente scritti in corsivo. La convenzione di scrittura dei genotipi è X/Y; 2nd/2nd; 3rd/3rd.
Nella comunità dei biologi molecolari la nomenclatura genetica della Drosophila è nota per i nomi fantasiosi associati alle mutazioni genetiche scoperte. Le mutazioni del lievito di birra o di altri organismi, microscopici e non, hanno solitamente nomi come "cdc4" e "cdk4"; nella Drosophila invece sono frequenti nomi come "cheap date" (letteralmente "appuntamento economico", una mutazione che rende il moscerino più sensibile all'effetto dell'etanolo) o "snafu" (una mutazione che provoca anomalie anatomiche grottesche).
L'embriogenesi nella Drosophila è stata studiata molto approfonditamente. La piccola dimensione, il ciclo di vita molto breve e la grande quantità di prole tipici della Drosophila ne fanno un campione ideale per studi genetici. È anche l'unico fra gli organismi modello in cui la suddivisione dell'ovulo fecondato avviene in una cavità sinciziale.
Durante l'ovogenesi, l'ovocita in formazione è connesso alle cellule nutrici dei ponti citoplasmatici. Sostanze nutrienti e altre molecole che controllano lo sviluppo si trasferiscono nell'ovocita.
Nella figura si può vedere come l'ovocita in formazione venga rivestito da cellule follicolari di supporto. Circa 5000 nuclei cellulari si ammassano nel citoplasma indiviso dell'ovocita prima che inizi la loro migrazione verso la superficie e vengano avvolti da membrane plasmatiche per formare le cellule che circondano il sacco del tuorlo. Poco dopo la linea germinale si separa dalle cellule somatiche, attraverso la formazione di cellule polari nell'estremità posteriore dell'embrione.
La divisione cellulare nei primi stadi dell'embrione di Drosophila avviene tanto rapidamente che non esistono fasi distinte, per cui possono verificarsi errori nella divisione del DNA. Per aggirare questo problema i nuclei che commettono tali errori si staccano dai loro centrosomi e cadono nel centro dell'embrione, che non farà parte dell'insetto.
La definizione degli assi antero-posteriore e dorso-ventrale avviene secondo un meccanismo definito specificazione sinciziale, in cui gradienti di geni materni, introdotti nell'oocita grazie alle cellule nutrici, definiscono gli assi del corpo prima ancora che l'oocita venga fecondato; in particolare i geni materni nanos e bicoid creano il gradiente morfogeno che specifica per le strutture anteriori (bicoid) e per quelle posteriori (nanos).
I geni materni agiscono come fattori di trascrizione attivando i geni zigotici. I primi geni zigotici ad essere trascritti sono la classe dei geni gap, il cui nome deriva dal fatto che la loro mutazione provoca una grossa perdita di segmenti nella larva del moscerino. I più importanti geni gap sono hunchback, kruppel, giant, knirps e tailless ognuno dei quali, in base a gradienti di concentrazione dei geni materni, è espresso in determinate regioni lungo l'asse antero/posteriore dell'embrione di drosophila dividendolo in unità distinte.
Combinazioni opportune di geni gap sono in grado di attivare specifici enhancer di promotori modulari dei geni della regola pari primari i quali vengono espressi periodicamente in sette strisce lungo l'asse antero-posteriore andando così a delineare un pattern di 14 zone discrete definite parasegmenti. La caratteristica principale di questa classe di geni è che alcuni di essi saranno espressi solo nei parasegmenti dispari mentre altri solo nei parasegmenti pari. Tali geni sono inoltre importanti per determinare il pattern di espressione dei geni della regola pari secondari: questi sono espressi inizialmente in tutto l'embrione ma a seguito dell'espressione dei geni della regola pari primari la loro espressione sarà limitata in quei parasegmenti non occupati da questi ultimi in quanto sono in grado di legare gli enhancer dei geni della regola pari secondari e regolarne negativamente l'espressione.
Una volta che i geni della regola pari sono espressi, questi ultimi attivano i geni della polarità segementale i quali definiscono il lato anteriore e posteriore di un parasegmento. In particolare nei 14 parasegmenti formati le file di cellule che mostrano un'alta concentrazione di prodotto genico dei geni della regola pari cominciano ad esprimere il gene della polarità segmentale chiamato engrailed che definisce il confine anteriore del parasegmento; a sua volta engrailed agisce come fattore di trascrizione facendo esprimere il gene hedgehog il quale venendo secreto dalle cellule va ad interagire con il recettore cellulare posto sulla fila di cellule anteriore a quelle esprimenti engrailed, ciò attiva una via di segnalazione intracellulare che permette di esprimere un altro gene della polarità segmentale chiamato wingless che definisce il confine posteriore del parasegmento. Wingless a sua volta viene secreto ed interagisce con il recettore frizzled della fila di cellule esprimenti engrailed il quale induce un via di segnalazione intracellulare che induce ulteriore espressione di engrailed chiudendo il circuito. Grazie a tale sistema, anche a seguito di cessato stimolo da parte dei geni della regola pari, questo circuito può automantenersi definendo in modo definitivo i confini di ogni parasegmento.
La combinazione di geni gap, della regola pari e della polarità segmentale fa esprimere l'ultima classe di geni per lo sviluppo della drosophila chiamati geni selettori omeotici. Tali geni definiscono in modo preciso il destino dello sviluppo di ogni parasegmento definendo se questo diventerà una zampa piuttosto che un'antenna.
La specificazione dell'asse dorso-ventrale è stabilito dal gradiente di concentrazione di un fattore di trascrizione chiamato dorsal. L'mRNA materno di dorsal è posto nell'oocita di Drosophila dalle cellule nutrici lungo tutto la membrana citoplasmatica dove viene tradotto 90 minuti dopo la fecondazione. Nonostante dorsal sia presente in tutto l'oocita esso entra solo nel nucleo delle cellule ventrali dove attiva geni per la ventralizzazione (twist e snail) e reprime quelli per la dorsalizzazione. Il fatto che dorsal entri solo nelle cellule ventrali è dovuto alla posizione all'interno del citoplasma del nucleo dell'oocita nel periodo che precede la fecondazione: trovandosi sul lato dorsale attiva fattori di trascrizione che inibiscono i geni necessari per attivare dorsal. Ciò non succede sul lato ventrale che si trova lontano dal nucleo ed in questo modo dorsal può esplicare la sua funzione ventralizzante.
Nel 1971 Ron Konopka e Seymour Benzer pubblicarono un articolo intitolato "Mutanti orologio di Drosophila melanogaster" in cui descrivevano la prima mutazione che influenzava il comportamento di un animale. I moscerini Drosophila normali mostravano un ritmo di attività e riposo coincidente grosso modo con il giorno solare (24 ore). I mutanti di Konopka e Benzer invece mostravano ritmi più rapidi o più lenti, e in alcuni casi del tutto irregolari: i moscerini mutanti riposavano ed erano attivi per periodi di tempo del tutto casuali. I lavori dei successivi 30 anni hanno dimostrato che queste mutazioni (e altre simili) interessano un gruppo di geni e di loro prodotti che formano un orologio biologico o molecolare. Questo orologio biologico è stato trovato in molte cellule del moscerino, ma quelle determinanti per il ciclo attività/riposo sono alcune dozzine di cellule nel cervello centrale della Drosophila.
Da allora Benzer, i suoi studenti e molti altri hanno usato maschere comportamentali per isolare geni coinvolti in visione, olfatto, udito, apprendimento e memoria, corteggiamento, dolore e altri processi biologici come la longevità.
L'occhio composto del moscerino della frutta contiene 800 unità oculari o ommatidi, ed è uno dei più sofisticati fra tutti gli insetti. Ogni ommatide contiene 8 cellule fotorecettrici (R1-8) ed alcune cellule di supporto, cellule pigmentate e una cornea. I moscerini normali hanno cellule pigmentate rossastre, per assorbire l'eccesso di luce blu e non venire accecati dalla luce del giorno.
Ogni fotorecettore consiste di due sezioni principali, il corpo cellulare e il rabdomero. Il corpo cellulare contiene il nucleo della cellula mentre il rabdomero è fatto di ammassi di membrane dette microvilli che lo rendono simile ad uno spazzolino da denti. Ogni microvillo è lungo da 1 µm a 1,5 µm ed ha un diametro di 50 nm. La membrana del rabdomero contiene circa 100 milioni di molecole di rodopsina, la proteina visuale che assorbe la luce. Il resto delle proteine della visione sono concentrate nello spazio microvillare, lasciando poco spazio al citoplasma.
I fotorecettori in Drosophila secernono molte varietà di forme di rodopsina. Le cellule fotorecettrici R1-R6 sintetizzano la Rodopsina1 (Rh1) che assorbe luce blu (480 nm). Le cellule R7 e R8 sintetizzano le forme Rh3 o Rh4 che assorbe luce ultravioletta (345 nm e 375 nm), e Rh5 o Rh6 che assorbono rispettivamente luce blu (437 nm) e verde (508 nm). Ogni molecola di rodopsina consiste di una proteina chiamata opsina legata in modo covalente ad un cromoforo carotenoide.
Come nella visione dei vertebrati, anche negli invertebrati la trasduzione visiva avviene tramite un cammino di proteine G accoppiate. Però nei vertebrati la proteina G è la transducina, mentre negli invertebrati è la Gq (dgq in Drosophila). Quando la rodopsina (Rh) assorbe un fotone, il suo cromoforo carotenoide si isomerizza, producendo in Rh un cambiamento conformazionale verso la sua forma attiva, la metarodopsina. Essa attiva la Gq, che a sua volta attiva una fosfolipasi Cβ (PLCβ) nota come NorpA.
PLCβ idrolizza il fosfatidilinositolo-4,5-bisfosfato (PIP2), un fosfolipide presente nella membrana cellulare, in inositolo-trifosfato (IP3) e diacilglicerolo (DAG). DAG, molecola idrofobica, rimane nella membrana, generando l'apertura di un canale ionico selettivo per il calcio (noto come TRP, transient receptor potential) e, a valle, l'ingresso nella cellula di ioni calcio e sodio. Il destino di IP3 è invece quello di legare specifici recettori (IP3 receptors) presso specifiche cisterne del reticolo endoplasmatico, generando l'uscita nel citoplasma di altri ioni calcio, sebbene questo processo non sia ritenuto essenziale per la normale visione.
Gli ioni calcio legano proteine come la calmodulina (CaM) e protein chinasi C (PKC) specifiche per la visione, note come InaC. Le InaC interagiscono poi con altre proteine a valle e sono ritenute le principali responsabili del segnale acceso/spento della visione. Hanno un certo ruolo nello spegnimento del processo visivo anche le arrestine, proteine in grado di inibire l'interazione della metarodopsina con le Gq, inibendo la trasduzione a monte.
Lo spegnimento avviene attraverso uno scambiatore sodio/calcio di membrana dipendente dal potassio (noto come NCKX30C), che pompa il calcio al di fuori della cellula. Ciò è permesso dai gradienti transmembrana favorevoli di sodio e potassio. Per ogni ione Ca++ estruso, 4 di Na+ entrano ed un di K+ esce dalla cellula.
La proteina InaD funge da supporto per tutte le proteine chiave della via di trasduzione: contiene cinque domini di legame (domini PDZ) per la regione C-terminale di molecole come TRP, InaC e PLC. Mutazioni a carico dei domini PDZ generano notevoli problemi nella trasduzione stessa. Ad esempio, un calo dell'interazione tra InaC e InaD genera una inattivazione tardiva della risposta alla luce.
A differenza della metarodopsina dei Vertebrata, la metarodopsina di Drosophila (e degli Invertebrata) viene riconvertita a rodopsina con il semplice assorbimento di un fotone di luce arancione (580 nm).
Circa due terzi del cervello di Drosophila (circa 200 000 neuroni) sono dedicati al processo visivo. Sebbene la risoluzione spaziale sia notevolmente minore di quella umana, la velocità della risposta visiva è quasi dieci volte maggiore.
Le ali di una mosca come Drosophila possono battere fino a 250 volte al secondo. Il volo è essenzialmente composto di lunghi tratti lineari, intervallati da rapidi cambi di direzione chiamati saccade. Durante queste "svolte", è in grado di ruotare di 90 gradi in meno di 50 millisecondi.
Drosophila, e probabilmente molte altre mosche, presenta nervi ottici collegati direttamente ai muscoli delle ali (mentre in altri insetti c'è in ogni caso un passaggio attraverso il cervello), rendendo se possibile ancora minore il tempo di reazione.
Si è creduto per lungo tempo che le caratteristiche del volo di Drosophila fossero sottoposte più alla viscosità dell'aria che all'inerzia del corpo dell'animale. Recenti ricerche di Michael Dickinson e Rosalyn Sayaman hanno invece indicato che è l'inerzia la forza dominante.
Il sesso in Drosophila similmente a pochi altri individui è un carattere quantitativo, questo è cioè determinato dal rapporto tra il numero di cromosomi X ed il numero degli assetti aploidi degli autosomi. Tale sistema di determinazione del sesso è chiamato "Sistema di equilibrio genico".
Sebbene il rapporto dei cromosomi X sugli aspetti aploidi degli autosomi X:A predica il sesso in D. melanogaster, è stato dimostrato che il ruolo di tale rapporto è indiretto, e che in realtà è il numero di cromosomi X a determinare il sesso, attraverso l'azione di proteine XSE (X-encoded signal element, elemento segnale codificato in X). Secondo tale modello l'azione degli autosomi sulla conta dei cromosomi X è in gran parte indiretta. Erickson JW e Quintero JJ hanno studiato, in particolare, aploidi (1X:1A), quindi con singolo cromosoma X (maschile) ma con fenotipo femminile, e triploidi intersessuali (XX:AA), con doppio cromosoma X (femminile). Si è scoperto che il promotore specifico nelle femmine di Sex-lethal (Sxl), Sxl-Pe, è attivo negli aploidi, in quanto una divisione nucleare precellulare extra eleva il numero dei cromosomi X, portando i livelli di XSE superiori alla soglia per la determinazione femminile del sesso. Gli embrioni triploidi, invece, cellularizzano un ciclo prima dei diploidi, col conseguente blocco prematuro di SxlPe. Il meccanismo autoregolato che mantiene alti i livelli di Sxl non si sviluppa in tutte le cellule, e queste formeranno un mosaico sessuale. Si ipotizza che in altri organismi che presentano una determinazione sessuale basata sull'equilibrio genico, come nel caso di Drosophila, il rapporto X:A possa non avere un ruolo diretto.[5]
La drosofila, o moscerino della frutta, (Drosophila (Sophophora) melanogaster Meigen, 1830) è un insetto dell'ordine dei Diptera. Si tratta di un organismo modello per la ricerca scientifica, in quanto è facilmente manipolabile e con un breve ciclo vitale.
Drosophila melanogaster (Graece; Latino autem sermone 'roris amator atro ventre') est insectum duarum alarum quod ad ordinem dipterorum pertinet. Ad diptera Muscae pertinent.
Drosophila melanogaster (Graece; Latino autem sermone 'roris amator atro ventre') est insectum duarum alarum quod ad ordinem dipterorum pertinet. Ad diptera Muscae pertinent.
Drosophila melanogaster adolah saikua lalek dari genus Drosophila. Spesies ko juo marupokan bagian dari famili Drosophila, ordo Diptera, kelas Insecta, filum Arthropoda, dan kingdom Animalia.
Istilah "Drosophila", baarati "panyuko ambun", adolah adaptasi saintifik Latin modern dari kato Yunani δρόσος, drósos, "ambun", dan δρόσος, drósos, "panyuko", nan ditambahkan jo akiaran Latin feminin -a.
Drosophila melanogaster adolah saikua lalek dari genus Drosophila. Spesies ko juo marupokan bagian dari famili Drosophila, ordo Diptera, kelas Insecta, filum Arthropoda, dan kingdom Animalia.
Istilah "Drosophila", baarati "panyuko ambun", adolah adaptasi saintifik Latin modern dari kato Yunani δρόσος, drósos, "ambun", dan δρόσος, drósos, "panyuko", nan ditambahkan jo akiaran Latin feminin -a.
Bari-bari, lalat buah biasa atau lalat cuka (vinegar fly) adalah sejenis lalat kecil yang selalu mengerumuni buah-buahan. Jangka hayat D. melanogaster adalah kira-kira 30 hari pada 29 °C (84 °F).
De bananenvlieg of fruitvlieg (Drosophila melanogaster) is een tweevleugelig insect uit de orde tweevleugeligen (Diptera).
De fruitvlieg is een van de bekendste soorten insecten, de vlieg is een modelorganisme dat op grote schaal gebruikt wordt binnen veel onderzoeksgebieden van de genetica. Dit komt omdat de chromosomen in bepaalde delen van het lichaam erg groot zijn en onder een eenvoudige microscoop zijn waar te nemen. Veel van wat we weten over de moleculaire processen van de ontwikkeling van organismen is ontdekt bij enkele modelorganismen zoals de fruitvlieg. De fruitvlieg is eenvoudig te kweken en heeft een snelle levenscyclus, de kweek van fruitvliegen is relatief goedkoop. De fruitvlieg wordt daarom op grote schaal gekweekt als voedseldier voor kleine insectenetende huisdieren.
Er zijn vele andere soorten fruitvliegen maar D. melanogaster is veruit de bekendste soort vanwege het veelvuldige gebruik van de vlieg voor laboratoriumexperimenten. De fruitvlieg is gemakkelijk op een suikerhoudende voedingsbodem te kweken en kan zich zeer snel voortplanten. De generatietijd bedraagt ongeveer 11 dagen in het laboratorium. De fruitvlieg is een relatief goedkoop onderzoeksobject en kent een korte levenscyclus, daarnaast kan ieder vrouwtje enige honderden nakomelingen voortbrengen. Een ander voordeel van het kweken van de fruitvlieg is dat mannetjes gemakkelijk van vrouwtjes te onderscheiden zijn. Een mannetje heeft namelijk een zwarte stip op zijn achterlichaam en een afgeronde achterlijfspunt. Een vrouwtje heeft een duidelijk stekelachtige achterlijfspunt en een zwarte vlek aan het achterlijf ontbreekt. De fruitvlieg heeft vier paar chromosomen.
De Nederlandstalige naam fruitvlieg is te danken aan de voorliefde van het insect voor fruit, de soort wordt ook wel bananenvlieg genoemd.[1] Ook in veel andere talen wordt verwezen naar het voedsel, zoals het Engelse 'fruit fly', het Duitse en het Spaanse 'mosca de la fruta'. In de Noorse en de Zweedse taal wordt de soort met bananenvlieg aangeduid, respectievelijk 'bananflue' en 'bananfluga'.
In de Franse taal wordt de naam 'mouche du vinaigre' gebruikt, wat azijnvlieg betekent. De soortnaam azijnvlieg wordt in de Nederlandse taal echter niet voor de fruitvlieg Drosophila melanogaster gebruikt maar voor de verwante soort Drosophila funebris. In het Duits is de officiële naam 'schwarzbäuchige taufliege', dat zwartbuik-dauwvlieg betekent. Deze naam slaat op de zwarte achterlijfspunt.
De wetenschappelijke naam Drosophila melanogaster betekent letterlijk vertaald dauwliefhebber met een zwarte buik. De soortnaam drosophila is een samenstelling van Oudgrieks δρόσος (drosos), dat dauw betekent en Oudgrieks φίλος (philos), dat liefhebber betekent. De soortnaam melanogaster komt van Oudgrieks μέλας (melas), dat zwart betekent en het Oudgrieks γαστήρ (gastēr), dat buik betekent.
De wetenschappelijke naam Drosophila wordt ook gebruikt voor een geslacht van schimmels uit de familie Agaricomycetidae, zie Drosophila (schimmel).[2]
De fruitvlieg werd voor het eerst wetenschappelijk beschreven door Johann Wilhelm Meigen in 1830. De vlieg was door Carolus Linnaeus beschreven als Musca cellaris in 1758. De fruitvlieg was al bij de Oude Grieken bekend.[3] De soort is ook wel beschreven als Drosophila melanocephala en Drosophila nigriventris. Zie voor een lijst van alle verouderde namen, ook wel synoniemen genoemd, de uitklapbare lijst rechts.
De fruitvlieg behoort tot de familie fruitvliegen, ook wel bananenvliegen of azijnvliegen genoemd.[1]
De fruitvlieg komt oorspronkelijk waarschijnlijk uit tropische delen van westelijk Afrika. De vlieg heeft zich van hieruit verspreid naar alle delen van de wereld, op Antarctica na. De fruitvlieg heeft zich pas vrij recentelijk naar Azië en Europa verspreid, ongeveer zes- tot tienduizend jaar geleden.[3] De fruitvlieg kwam mee met de mens en kan zich handhaven in koelere streken doordat de vliegen zich in geïsoleerde gebieden kunnen blijven voortplanten.
Later kwam de fruitvlieg terecht in Australië en vele oceanische eilanden, altijd door toedoen van de mens. In Noord- en Zuid-Amerika is de fruitvlieg pas sinds 500 jaar bekend. Hier heeft de vlieg zich waarschijnlijk gevestigd door mee te liften op schepen die slaven vervoerden.[3]
De fruitvlieg kan overal leven waar fruit of andere gistende organische stoffen voorhanden zijn. Ook mag het niet te koud zijn en moet de lucht relatief vochtig zijn. Fruitvliegen kunnen zeer slecht tegen droogte. Het areaal wordt tevens begrensd door heel koude of juist warme gebieden zoals bergstreken en woestijnen.[4]
De fruitvlieg bereikt een lichaamslengte van ongeveer twee tot drie millimeter. De vrouwtjes worden gemiddeld iets groter dan de mannetjes. Omdat de vleugels aan de achterzijde wat uitsteken lijken de diertjes nog iets groter. Opvallend zijn de grote, rode ogen en het bolle, gewelfde borststuk.
De kop is duidelijk te onderscheiden door de grote samengestelde ogen die bovendien een dieprode kleur hebben. De ogen zijn relatief groot en bestaan uit vele tientallen kleine suboogjes. Tussen de oogjes zijn microscopisch kleine haartjes gelegen. De fruitvlieg kan met de ogen alleen bewegingen of veranderende schaduwen zien, de vlieg reageert op bewegingen door hiervan weg te vliegen. De ogen kunnen ook lichtverschuivingen waarnemen. De fruitvlieg is positief fototactisch, wat betekent dat het licht wordt opgezocht. Dit in tegenstelling tot de larven, die licht juist mijden. De voorkeur voor licht is duidelijk te zien bij volwassen vliegen die in een doorzichtig bakje worden gehouden. Deze bewegen zich duidelijk altijd naar de zijde waar het meeste licht doordringt.
Aan de bovenzijde zijn drie puntogen aanwezig, die uit een individueel oogje bestaan. Deze drie oogjes worden de ocelli genoemd en zijn dicht tegen elkaar gelegen. De ocelli hebben een ondergeschikte visuele functie. De oogjes zijn gelegen op het kopschild of vertex aan de bovenzijde van de kop. Aan de voorkant is onder de antennes het 'gezicht' of clypeus gelegen.
De fruitvlieg heeft net als alle vliegen relatief korte antennes die bestaan uit drie segmenten. Het eerste segment is het kortst, het tweede is langer en duidelijk dikker dan het eerste segment. Het derde segment is ongeveer even dik als het tweede segment maar is duidelijk langer. Aan de bovenzijde van het derde antennesegment is bij de fruitvlieg een langwerpig uitgroeisel aanwezig, dat duidelijk langer is dan de antenne zelf. Deze structuur wordt de arista genoemd en bestaat uit een dunne steel die voorzien is van een borstelige beharing.[5]
Het borststuk valt op omdat het relatief groot en bol is. Aan de achterzijde van de bovenkant van het borststuk is een klein, schubachtig schildje aanwezig, het scutellum. Het borststuk draagt dikke, zwarte haren. Deze haren worden macrochaetae genoemd; macro betekent groot en chaeta betekent stijve haar. Tussen de grotere haren zijn ook kleinere haartjes aanwezig. De haren op het borststuk hebben een mechanosensorische functie, ze zijn heel gevoelig in het waarnemen van luchtwervelingen. Een fruitvlieg kan hierdoor een mogelijke vijand waarnemen door de veranderende luchtdruk die het naderende object veroorzaakt.
De fruitvlieg heeft een in drieën verdeeld borststuk, aan de onderzijde draagt ieder deel een paar poten. De achterste twee delen van het borststuk dragen bij de meeste insecten steeds één paar vleugels aan de bovenzijde, dus twee paar in totaal. Bij de tweevleugeligen echter heeft alleen het middelste deel van het borststuk een paar vleugels.
De vleugels van de fruitvlieg zijn transparant en hebben nooit vlekken zoals verwante soorten vaak wel hebben. De buitenste randen van de vleugels zijn steviger en donkerder van kleur. De vleugels worden in rust boven het lichaam gevouwen, waarbij de vleugelranden elkaar twee keer kruisen.[6] De achtervleugels aan het derde borststuksegment zijn omgevormd tot kleine haltertjes. Deze dienen als een soort gyroscoop, ze maken de vlieg wendbaarder tijdens het vliegen. Bij de meeste vliegen is een soort kapje aanwezig voor de halters, die de calyptra wordt genoemd. Bij de fruitvliegen echter ontbreken deze structuren. De fruitvliegen worden daarom wel met acalyptrata aangeduid, wat 'zonder (a) calyptra' betekent.
De drie paar poten van de fruitvlieg zijn vaak roodbruin gekleurd, ze bestaan uit een aantal segmenten. Vanaf het lichaam gezien zijn dit de coxa of heup, deze is middels de smalle trochanter of dijbeenring verbonden met het femur of dij, gevolgd door de tibia of scheen en ten slotte de tarsus of voet. De tarsus is het enige deel van de poot dat zelf ook uit verschillende segmenten bestaat. De tarsus heeft altijd vijf geledingen die naar het uiteinde toe steeds smaller worden. Op het eerste tarsussegment en op de scheen zijn borstelachtige rijen kleine haren aanwezig.[7] Aan het einde van de poot zijn altijd twee haakjes gepositioneerd die dienen als kleine klauwtjes.
Bij de mannetjes is aan het eerste tarsussegment een kleine kamachtige structuur aanwezig. Deze bestaat uit negen tot elf kleine, zwarte haartjes, en dient om het vrouwtje vast te houden tijdens de paring. Uit onderzoek waarbij de mannetje zo werden gemodificeerd dat de kammen zich niet ontwikkelen, bleek dat ze nog moeilijk in staat zijn om met een vrouwtje te paren.[8]
Het achterlijf of abdomen bestaat altijd uit acht delen die de achterlijfssegmenten worden genoemd. Het achterlijf is geler van kleur dan het borststuk en is voorzien van zwarte dwarsstrepen aan de middelste en achterste segmenten. De kleuren van het achterlijf en de vorm van de achterzijde verschillen per sekse, de vrouwtjes hebben een geel gekleurd achterlijf met vijf donkere banden. De middelste drie banden hebben soms in het midden aan de bovenzijde een vlek. De bovenste en onderste band hebben meestal geen vlek. Het achterlijf van vrouwtjes is relatief groter en ook duidelijk puntiger dan het meer afgeronde achterlijf van de mannetjes.
De mannetjes hebben slechts twee donkere banden op het achterlijf. De derde band en het achterliggende deel van het achterlijf zijn donker tot zwart van kleur. Deze seksuele dimorfie is met het blote oog goed te zien. Alleen bij net uit de pop geslopen exemplaren zijn de donkere achterlijfsdelen nog licht van kleur maar de dieren kleuren snel bij.
De soort Drosophila melanogaster is van alle fruitvliegen de bekendste soort. In België en Nederland komt de azijnvlieg (Drosophila funebris) veel voor. Deze heeft nooit een geprononceerd zwart achterlijf, wel komen exemplaren voor met donkere banden. Andere bekendere soorten zijn Drosophila hydei en Drosophila virilis. Net zoals de 'gewone' fruitvlieg worden deze soorten vaak gekweekt als voedseldieren voor kleine hagedissen en geleedpotigen zoals bidsprinkhanen. Ze worden wat groter dan de fruitvlieg, Drosophila hydei kan niet vliegen en van Drosophila virilis is bekend dat de soort wat bestendiger is dan de andere twee soorten.
Drosophila suzukii is een verwante soort die bekendstaat als plaaginsect op fruitbomen, planten zoals tomaat en verschillende sierplanten zoals soorten uit het geslacht Camellia.[9] De fruitvlieg behoort tot de familie Drosophilidae, die vertegenwoordigd wordt door ongeveer 3000 soorten. Fruitvliegen lijken sterk op elkaar wat betreft lichaamsbouw maar de kleuren van de verschillende soorten kunnen heel anders zijn. De Middellandse-zeevlieg (Ceratitis capitata) bijvoorbeeld heeft rode en blauwe kleuren en duidelijk gevlekte vleugels. Sommige andere soorten fruitvliegen zijn sterk gespecialiseerd op andere voedingsbronnen dan fruit. De larven van Drosophila sigmoides bijvoorbeeld leven in het schuim van een groep cicaden.[10]
Drosophila busckii: vlekkenrijen op lichaam.
Drosophila hydei: meestal zwart lichaam.
Drosophila setosimentum: sterk gevlekte vleugels.
Drosophila suzukii: enkele vlek op vleugel.
Fruitvliegen leven van gistende, suikerhoudende plantendelen en in de praktijk is dit vrijwel altijd fermenterend fruit. De eieren worden in rottende plantendelen afgezet zodat de larven die uit het ei kruipen voorzien zijn van voedsel. Vaak worden de eieren in rijpe, maar nog niet rottende delen afgezet zodat de jonge larven over 'vers' rottend voedsel beschikken.[4] Ze hebben daarbij de voorkeur voor citrusvruchten.[11] De larven boren zich in het voedsel en leven van gistcellen die zich manifesteren op rottende organische plantendelen die veel suikers bevatten. Vrijwel alle soorten fruit zijn geschikt als voedsel, maar vooral kersen en bananen hebben een grote voorkeur. Fruitvliegen worden door hun voedselkeuze wereldwijd gezien als een belangrijk plaaginsect.
De larven leven van de bacteriën en de gistcellen in het voedsel. Sterk beschimmeld voedsel wordt echter genegeerd. In het laboratorium gekweekte larven worden gevoerd met een papje dat bestaat uit meel en bakkersgist waaraan agar wordt toegevoegd zodat het geheel een geleiachtige structuur verkrijgt.
Als fruit begint te rotten (gisten) zetten de gistcellen de suikers om in alcohol. De volwassen vliegen worden sterk aangetrokken door de geur van alcohol. Alcoholhoudende dranken hebben hierdoor een onweerstaanbare aantrekkingskracht op fruitvliegen. Vooral dranken die op fruit zijn gebaseerd hebben een voorkeur, zoals wijn.
De fruitvlieg wordt gegeten door een breed scala aan insecteneters. Voorbeelden zijn spinnen, vleesetende kevers en rovende vliegen. De fruitvlieg kent ook gespecialiseerde vijanden, die voornamelijk op de fruitvlieg jagen. Een voorbeeld is de parasitaire schildwesp Asobara tabida. Deze wesp zet een ei af in de larve van de fruitvlieg. De larve van de wesp eet de vliegenlarve vervolgens van binnenuit op. Na de verpopping kruipt een jonge wesp uit de pophuid in plaats een nieuwe fruitvlieg. Een dergelijke parasiet wordt wel een parasitoïde genoemd, omdat de fruitvlieg te gronde wordt gericht.
De mannetjes zoeken de vrouwtjes op, van fruitvliegen is bekend dat ze gemakkelijk paren en zich ook in kleine ruimtes voortplanten. De levenscyclus is als volgt: ei → larve (1) → larve (2) → larve (3) → pop → volwassen insect of imago. Het gehele proces kan zich binnen twee weken voltrekken. Dit gaat relatief gezien zeer snel; een fruitvlieg verandert in ten minste zeven dagen van een klompje cellen tot een volledig ontwikkeld insect met spieren, een brein en het vermogen om te vliegen.
De verschillende soorten fruitvliegen lijken sterk op elkaar, daarom vindt een balts plaats waarbij de twee partners moeten vaststellen of ze tot dezelfde soort behoren voordat de paring plaatsvindt.[10] Een vrouwtje zal een mannetje alleen accepteren als hij eruitziet als een soortgenoot en daarnaast moet hij ruiken en bewegen als een geschikte partner.
De balts van de mannelijke fruitvlieg bestaat uit het rond het vrouwtje lopen en haar met de kop aan te raken. Ondertussen trilt het mannetje met zijn vleugels wat een gezoem veroorzaakt. De frequentie van het gezoem is soms soortspecifiek en de vrouwtjes kunnen alleen de frequentie van soortgenoten waarnemen. Mannetjes van andere soorten, die een andere toon gezoem veroorzaken, kan het vrouwtje simpelweg niet horen. Als een mannetje niet met de juiste toon zoemt of als het vrouwtje al bevrucht is door een ander mannetje, vliegt ze weg of begint zelf luid te zoemen om het mannetje van zich af te houden.[10]
Bij de paring klimt het mannetje op het vrouwtje waarbij hij zich vasthoudt met de copulatieborstels aan zijn voorpoten. Vervolgens maken de achterlijfspunten contact en vindt de bevruchting plaats. Het vrouwtje zet enige tijd later de eieren af met behulp van de eilegkleppen aan de achterzijde van het lichaam.
Mannetjes kunnen met meerdere vrouwtjes paren, de vrouwtjes echter kunnen maar één keer paren.[3] Van bepaalde soorten vliegen is een verschijnsel bekend waarbij een mannetje toch zijn sperma inbrengt bij een vrouwtje dat al gepaard heeft met een ander mannetje. Dit komt waarschijnlijk ook voor bij de fruitvlieg en het verschijnsel wordt wel traumatische inseminatie genoemd. Bij traumatische inseminatie worden de spermacellen niet via de geslachtsopening ingebracht maar simpelweg door de lichaamswand. De mannetjes maken daarvoor gebruik van een aanhangsel van hun verharde aedeagus of geslachtsorgaan om een opening in het vrouwtje te maken. Deze manier van bevruchting resulteert bij de vrouwtjes in wondjes.[12]
De mannetjes brengen bij de copulatie zo'n 300 tot 700 spermacellen over in het geslachtsorgaan van een vrouwtje. De spermacellen hebben een relatief zeer lange staart, een spermacel kan een totale lengte bereiken tot 1,76 millimeter.[13] De mannelijke geslachtscellen zijn hiermee 35 keer zo lang als die van een mens. De zaadcel van een mannetje dringt het ei binnen door een zeer kleine opening in de eiwand, de micropyle genoemd, waarbij het ei wordt bevrucht.
Het vrouwtje zet ongeveer 400 eitjes af in totaal. Deze worden in kleine groepjes van ongeveer vijf afgezet op het substraat.[6] Het ei is wit van kleur en is langwerpig en opvallend plat van vorm. Aan één zijde zijn twee draadachtige uitsteeksels aanwezig. Deze zijn hol van binnen en dienen als luchtkanaal. De eieren worden vaak afgezet op half vloeibaar materiaal, waarin de eieren deels wegzinken. Door de twee adembuizen kan het embryo van een in het substraat verzonken ei toch aan zijn zuurstofbehoefte voorzien. Bij de juiste temperatuur komt het ei na 12 tot 15 uur uit, waarbij de wormachtige larven verschijnen.[6]
De larven zijn wit en madeachtig, ze zijn pootloos en worden zeven tot acht millimeter lang.[3] Het larvestadium bestaat uit drie delen, die de instars worden genoemd. De verschillende larvale stadia of instars worden onderbroken door een vervelling, waarbij de oude huid wordt afgeworpen.
De larven zijn half doorzichtig en een aantal lichaamsdelen zijn door de huid heen te zien. De kop is aan de voorzijde zichtbaar als een zwart puntje, dit komt door de zwarte, in de kop gelegen monddelen. Het lichaam van de larven bestaat uit acht segmenten, ieder segment is voorzien van een ring van kleine stekelige bultjes met haartjes die een zintuiglijke functie hebben. Bij veel larven van insecten is er aan iedere segmentopening aan het achterlijf een kleine ademopening aanwezig, de zogenaamde stigmata. Bij de larve van de fruitvlieg ontbreken deze maar zijn er zowel aan de voorzijde van het lichaam twee openingen gelegen en aan de achterzijde zijn twee wat grotere, geveerde structuren te zien die oranje tot bruin van kleur zijn.
De larven zijn negatief fototactisch, dit wil zeggen dat ze een hekel hebben aan licht. Zodra licht wordt waargenomen kruipt de larve hiervan weg. De larven bezitten enige vorm van fotoreceptorische zintuigen aan de kop, waarop zich lichtgevoelige cellen bevinden. De larven hebben echter over het gehele lichaam zintuiglijke cellen die licht kunnen waarnemen. Omdat de larven in het voedsel leven waar ze van eten, is hun natuurlijke leefomgeving altijd donker. Als ze zich in het licht begeven zijn ze buiten hun natuurlijke leefomgeving en hier reageren de larven op door zich van het licht af te begeven.
De larven bewegen zich voort door het achterste deel van het lichaam op te heffen en door spierbewegingen deze lus aan de achterzijde naar voren te bewegen. Aan de voorzijde wordt ten slotte de kop naar voren bewogen waarna de cyclus opnieuw begint. De larven hebben een peristaltische, rupsachtige manier van voortbeweging.
Als de larve zich volledig heeft ontwikkeld vindt de verpopping plaats. De larve maakt hiertoe een pophuid of chrysalis in de laatste larvehuid. De larve transformeert in de pop van een wormachtige larve tot een volwassen insect met poten en vleugels. Dit wordt ook wel een volledige metamorfose genoemd. Niet alleen uiterlijk ziet de vlieg er anders uit dan de larven, ook inwendig wordt het dier gedurende het popstadium volledig omgebouwd. Het middelste deel van de darmen bijvoorbeeld wordt aanzienlijk korter tijdens de metamorfose.
De pop heeft kleine vederachtige uitsteekseltjes aan de achterzijde waardoor de ademhaling plaatsvindt. Jonge poppen zijn witgeel van kleur, oudere poppen kleuren bruiner. Als de pop bijna is ontwikkeld worden de ogen van de vlieg zichtbaar als donkere plekken aan weerszijden van de pop.
De fruitvlieg is, nadat deze de pophuid verlaten heeft, binnen een week volwassen en in staat om zich voort te planten. Het volwassen insect wordt ook wel de imago genoemd. In gevangenschap kan de vlieg ongeveer vier maanden oud worden.[4] In de natuur wordt deze leeftijd echter niet gehaald.
Als er zeer veel exemplaren in een betrekkelijk kleine ruimte voorkomen, worden de dieren voortdurend gestoord bij de paring en het afzetten van de eieren. Hierdoor zetten vrouwtjes minder eitjes af. Ook rusten de vliegen minder, hierdoor neemt hun levensduur af tot ongeveer twee weken.
De fruitvlieg is een soort die niet alleen als schadelijk wordt gezien, maar ook wordt gewaardeerd om de verschillende toepassingsgebieden. Omdat de fruitvlieg zich gemakkelijk laat kweken, is hij een belangrijk voedseldier voor kleinere insecteneters. Daarnaast kunnen de chromosomen van de vlieg relatief gemakkelijk worden bestudeerd omdat ze erg groot worden.
De fruitvlieg is een van de bekendste wereldwijd voorkomende plaaginsecten. De fruitvlieg is veel aanwezig in bedrijven waar producten die fruit of gist bevatten worden verwerkt of opgeslagen. De fruitvlieg komt veel voor in en rond composthopen, horecagelegenheden, brouwerijen en de detailhandel zoals supermarkten en groentewinkels. Het is een van de weinige plaaginsecten die zich ook gemakkelijk manifesteren in het dagelijks leven. Ieder huishouden kan worden geconfronteerd met de insecten als men groenten of fruit enige tijd laat staan. Na ongeveer een week zullen hieruit vele fruitvliegjes tevoorschijn komen en eromheen zwermen.
De fruitvlieg is aan te merken als schadelijk omdat ze schimmels, bacteriën en gistcellen verspreiden. De larven leven in het fruit en versnellen het rottingsproces aanzienlijk. De volwassen vliegen verplaatsen zich van fruit naar fruit en dragen hierbij de schimmels en gistcellen over die vervolgens de kans krijgen om een nieuwe bron te koloniseren. De fruitvlieg creëert op deze wijze meer potentiële voedselbronnen voor de larven.
De fruitvlieg wordt veel gekweekt in gevangenschap, deels om te dienen als voedingsbron voor andere dieren maar ook wordt de vlieg gebruikt in experimenten met betrekking tot bevolkingsdichtheid. Ook in de genetica worden de vliegen veel bestudeerd.
Het kweken van de fruitvlieg is eenvoudig. De vlieg kan in een kleine ruimte zoals een melkfles worden opgekweekt, waarbij zich binnen korte tijd zeer grote aantallen kunnen ontwikkelen.
Fruitvliegjes zijn bijzonder geschikt bij het opkweken van jonge of kleine geleedpotigen die als exotisch huisdier worden gehouden. Voorbeelden zijn jonge spinnen, schorpioenen en bidsprinkhanen. Ook jonge hagedissen en kikkers en sommige zeer klein blijvende hagedissen zoals kogelvingergekko's kunnen het best met fruitvliegjes worden grootgebracht.
De fruitvlieg wordt al sinds lange tijd gebruikt als modelorganisme in de genetica, de fruitvlieg is een van de weinige dieren waarbij de chromosomen met een eenvoudige lichtmicroscoop zichtbaar zijn. Dit is al lang bekend, de relatie tussen verschillen in actieve en niet-actieve chromosomen werd voor het eerst uitgebreid onderzocht door Thomas Hunt Morgan, die de basis legde voor de moderne genetica.[1] Morgan zou onder andere door zijn onderzoek aan de fruitvlieg in 1933 een Nobelprijs ontvangen. Veel later, in 1995, kregen Ed Lewis, Eric Weischaus en Christiane Nüsslein-Volhard eveneens een Nobelprijs voor hun onderzoek dat gebaseerd was op de genetische kenmerken van de fruitvlieg.[3]
De chromosomen zijn in vergelijking met die in de rest van het lichaam ongewoon groot. Het betreft dan alleen de chromosomen in de speekselklieren van de larven in het derde stadium, dus vlak voor de verpopping. De speekselklieren van de larve kunnen onder een microscoop worden verwijderd en geprepareerd.[14]
De vergrote chromosomen ontstaan doordat de samengetrokken DNA-strengen van een chromosoom zich na verdubbeling niet van elkaar losmaken. Ze blijven parallel naast elkaar liggen en na kleuring zijn ze goed waarneembaar met een lichtmicroscoop. Deze eigenschap maakte het diertje tot een ideaal proefdier voor genetisch onderzoek in de tijd dat moleculaire technieken nog niet waren ontwikkeld. Deze speekselklierchromosomen vertonen namelijk na bewerking en kleuring een bandenstructuur die wordt veroorzaakt doordat actieve regionen van het chromosoom anders gekleurd zijn dan rustende. Dit kon worden gecorreleerd met waarnemingen van mutaties en fysiologische processen in de fruitvlieg.
De fruitvlieg was een van de eerste organismen waarbij de hoxgenen in kaart werden gebracht. Deze genen spelen een cruciale rol bij het vormen van de verschillende lichaamssegmenten in het groeiende embryo. De hoxgenen bleken niet alleen bij de fruitvlieg, maar bij alle organismen aanwezig te zijn. De genen bepalen de opbouw van de verschillende lichaamssegmenten. Bij een mutatie aan de hoxgenen kunnen drastische effecten optreden, omdat de lichaamsvorm hierbij geheel verandert. Bij een bepaalde mutatie van de fruitvlieg is de vorm van de antennes sterk afwijkend. Bij deze mutatie, die wel antennapedia wordt genoemd, zien de antennes eruit als poten. Het eerste antennedeel ontwikkelt zich hierbij tot de heup, het tweede antennedeel vormt de trochanter, en het derde deel vormt de scheen, de dij en het eerste tarsale segment. Uit de arista ten slotte ontstaan de overige tarsale segmenten.[15]
Er zijn vele duizenden verschillende mutanten van de fruitvlieg bekend, waarbij dus een stukje DNA is veranderd. Hierdoor bevat het DNA een andere code, waardoor er geen of veranderde eiwitten worden aangemaakt. Dit zorgt voor andere eigenschappen dan bij de normale fruitvlieg zoals deze in het wild voorkomt. In sommige gevallen zijn deze eigenschappen ook duidelijk zichtbaar. Voorbeelden zijn de gekrulde vleugels (vestigial) in plaats van normale vleugels, een donkere huid (ebony) in plaats van een geelbruine huid, en witte ogen (white) in plaats van rode ogen.
Ook kan de oogvorm sterk veranderen, zo is er een mutatie die staafvormige ogen heeft (bar-eyed) en een mutatie met stervormige ogen (star-eyed). Deze laatste mutatie blijkt echter niet levensvatbaar en de fruitvlieg sterft in zijn pop.
De mutanten kunnen niet alleen in uiterlijk verschillen maar ook het gedrag kan afwijken. Daarnaast kunnen de verschillende lichaamsprocessen verstoord worden, zoals een afwijkend hartritme.
Het belang van de fruitvlieg voor genetisch onderzoek is door de hoge vlucht die de moleculaire biologie in de genetica heeft genomen wat verminderd, maar het blijft een van de belangrijkste proefdieren in het laboratorium. Behalve de korte levenscyclus zijn ook de lage kostprijs en onderhoudskosten van de fruitvlieg een voordeel. Voorts is er voor de proefnemingen met dit dier geen vergunning nodig, zoals dat wel het geval is bij muizen, apen of andere proefdieren. Zij kunnen worden ingezet voor onderzoek naar ziekten, zoals kanker, alzheimer en parkinson.[16]
Referenties
Bronnen
De bananenvlieg of fruitvlieg (Drosophila melanogaster) is een tweevleugelig insect uit de orde tweevleugeligen (Diptera).
De fruitvlieg is een van de bekendste soorten insecten, de vlieg is een modelorganisme dat op grote schaal gebruikt wordt binnen veel onderzoeksgebieden van de genetica. Dit komt omdat de chromosomen in bepaalde delen van het lichaam erg groot zijn en onder een eenvoudige microscoop zijn waar te nemen. Veel van wat we weten over de moleculaire processen van de ontwikkeling van organismen is ontdekt bij enkele modelorganismen zoals de fruitvlieg. De fruitvlieg is eenvoudig te kweken en heeft een snelle levenscyclus, de kweek van fruitvliegen is relatief goedkoop. De fruitvlieg wordt daarom op grote schaal gekweekt als voedseldier voor kleine insectenetende huisdieren.
Er zijn vele andere soorten fruitvliegen maar D. melanogaster is veruit de bekendste soort vanwege het veelvuldige gebruik van de vlieg voor laboratoriumexperimenten. De fruitvlieg is gemakkelijk op een suikerhoudende voedingsbodem te kweken en kan zich zeer snel voortplanten. De generatietijd bedraagt ongeveer 11 dagen in het laboratorium. De fruitvlieg is een relatief goedkoop onderzoeksobject en kent een korte levenscyclus, daarnaast kan ieder vrouwtje enige honderden nakomelingen voortbrengen. Een ander voordeel van het kweken van de fruitvlieg is dat mannetjes gemakkelijk van vrouwtjes te onderscheiden zijn. Een mannetje heeft namelijk een zwarte stip op zijn achterlichaam en een afgeronde achterlijfspunt. Een vrouwtje heeft een duidelijk stekelachtige achterlijfspunt en een zwarte vlek aan het achterlijf ontbreekt. De fruitvlieg heeft vier paar chromosomen.
Bananfluge (Drosophila melanogaster) er ei fruktfluge som hovudsakleg er kjend for å ha vorte brukt mykje som modellorganisme i genetikk og utviklingsbiologi.
Bananflue (Drosophila melanogaster) er en flue i familien fruktfluer (Drosophilidae). Den er fra 1 mm til ca. 6 mm lang.
Kroppen er ofte lys brun, gjerne med en mørkere bakkropp som hos noen arter har striper eller mørkere partier. Bananfluer er små avlange, bevingede fluer. Øynene er ofte lysende og ofte røde. Eggene legges på plasser med gjærsopp, bakterier eller andre mikroorganismer. Bananfluer legger opp til flere hundre egg om dagen. Alle fluer gjennomgår en fullstendig forvandling, med et puppestadium.
Bananfluer har blitt et mer vanlig problem i kjøkkenet etter at det ble innført tvungen kompostering i form av innsamling av matavfall i kommunene. I varme lokaler og gjerne på sommeren kan en lett få store problemer med bananfluer. Siden de legger masser av egg, kan det være vanskelig å bli kvitt dem når de først har etablert seg. Renhold og fjerning av matrester er viktig. Det kan også være forebyggende å benytte seg av lysfeller. Dette er innretninger med UV-lys som tiltrekker seg fluer. Disse blir fanget i disse lysfellene slik at de ikke kommer i maten. De fleste restauranter og storkjøkken har lysfeller for å forebygge problemer med fluer.
Bananfluen Drosophila melanogaster er nok den best kjente arten av fruktfluene, den er mye brukt i genetiske eksperimenter, fordi:
Bananflue (Drosophila melanogaster) er en flue i familien fruktfluer (Drosophilidae). Den er fra 1 mm til ca. 6 mm lang.
Kroppen er ofte lys brun, gjerne med en mørkere bakkropp som hos noen arter har striper eller mørkere partier. Bananfluer er små avlange, bevingede fluer. Øynene er ofte lysende og ofte røde. Eggene legges på plasser med gjærsopp, bakterier eller andre mikroorganismer. Bananfluer legger opp til flere hundre egg om dagen. Alle fluer gjennomgår en fullstendig forvandling, med et puppestadium.
Bananfluer har blitt et mer vanlig problem i kjøkkenet etter at det ble innført tvungen kompostering i form av innsamling av matavfall i kommunene. I varme lokaler og gjerne på sommeren kan en lett få store problemer med bananfluer. Siden de legger masser av egg, kan det være vanskelig å bli kvitt dem når de først har etablert seg. Renhold og fjerning av matrester er viktig. Det kan også være forebyggende å benytte seg av lysfeller. Dette er innretninger med UV-lys som tiltrekker seg fluer. Disse blir fanget i disse lysfellene slik at de ikke kommer i maten. De fleste restauranter og storkjøkken har lysfeller for å forebygge problemer med fluer.

Wywilżna karłowata[2][3][4], drozofila karłówka[4], muszka owocowa, wywilżnia[5][6], wywilżanka[3], drozofila[3][5][6], octówka[5] (Drosophila melanogaster) – niewielki owad (wielkości 2–3 mm) z rzędu muchówek. Jest gatunkiem należącym do bezkręgowych organizmów modelowych. Został użyty przez Thomasa Morgana w badaniach nad chromosomową teorią dziedziczności. Owad ten jest też jednym z pierwszych zwierząt wykorzystywanych w bioastronautyce – od 1952 w lotach balonowych w górne warstwy atmosfery – i pierwszym zwierzęciem umieszczonym przez ludzi w przestrzeni kosmicznej (20 lutego 1947).
W środowisku naturalnym owady te spotkać można w pobliżu drzew owocowych, wokół fermentujących owoców, ale przywabiają je także zapachy produktów jak wino, konfitury, dżemy i ocet. Nazwa muszka owocowa pochodzi stąd, iż owady te odżywiają się drożdżami żyjącymi na gnijących owocach. Nie jest więc szkodnikiem upraw rolnych, choć może powodować szkody w przetworach owocowych.
Muchówka o ciele długości około 2 mm. Głowa jest żółta. Na głowie para szczecinek orbitalnych skierowanych w tył jest znacznie cieńsza niż ich para skierowana w przód. Czułki mają człon trzeci krótko owłosiony, co najwyżej półtora raza dłuższy niż szeroki i nie dłuższy niż dwukrotność długości członu drugiego, zaś aristę z wierzchołkowym rozwidleniem i co najmniej dwoma promieniami na spodniej stronie. Tułów ma barwę żółtą do brązowawożółtej. Chetotaksję tułowia cechuje 8 przedszwowych rzędów szczecinek środkowych grzbietu w przedniej części śródplecza, w których wszystkie szczecinki są tak samo krótkie, brak dłuższych szczecinek śródplecowych przed szwem poprzecznym oraz spośród trzech górnych par szczecinek sternopleuralnych przednia najkrótsza, a tylna najdłuższa. Użyłkowanie skrzydła odznacza się żyłką subkostalną bez sierpowatego zakrzywienia za żyłką barkową, tylną komórką bazalną zlaną z komórką dyskoidalną oraz wierzchołkowym odcinkiem żyłki medialnej M1+2 nie dłuższym niż trzykrotność odcinka tej żyłki między żyłkami poprzecznymi przednią i tylną. Wszystkie pary odnóży mają szczecinki przedwierzchołkowe na goleniach. Przednie stopy mają pierwszy człon znacznie krótszy niż drugi i trzeci razem wzięte, a u samca charakteryzują się obecnością grzebienia z drobnych, czarnych kolców. Żółty odwłok ma czarne przepaski na tylnych brzegach tergitów oraz czarny wierzchołek[7].
Drosophila melanogaster jest jednym z pierwszych eukariotycznych organizmów, których DNA zostało całkowicie zsekwencjonowane.
W genetyce funkcjonuje jako gatunek modelowy od czasów wybitnych prac Thomasa Morgana z początku XX wieku. Dzięki łatwej hodowli, prostemu sposobowi krzyżowania oraz szybkiemu wzrostowi (zdolne do rozmnażania po 8–12 godzinach po przepoczwarczeniu)[a] są one powszechnie stosowane w badaniach genetycznych, a także jako żywy pokarm dla niektórych ryb akwariowych i gadów. Genom muszki jest niewielki (haploid) zawiera ok. 131–165 milionów par nukleotydów, a liczba genów wynosi ok. 14 tysięcy. Drosophila melanogaster posiada jedynie 4 pary chromosomów – po 3 pary autosomów i 1 parę chromosomów płci (XY – samce, XX – samice). Ponad 25% każdego chromosomu to heterochromatyna zlokalizowana w części centralnej i telomerach. Ze względu na to, że większość genów znajduje się w euchromatynie ułatwia to mapowanie genowe. Istotne dla badań jest istnienie chromosomów politenicznych (np. dla hybrydyzacji in situ dla lokalizacji markerów w chromosomie). Powstają one przez 10-krotną replikację DNA, które nie jest przedzielone podziałami mitotycznymi. Występują w gruczołach ślinowych, komórkach przewodu pokarmowego, cewkach Malpighiego i komórkach tłuszczowych.
Thomas Morgan przeprowadził pierwsze eksperymenty na Drosophila melanogaster w 1908 roku. Badania umożliwiły sformułowanie chromosomowej teorii dziedziczności, za którą w 1933 roku otrzymał Nagrodą Nobla („za odkrycia dotyczące roli chromosomu w dziedziczeniu”). W następnych dziesięcioleciach D. melanogaster była badana w setkach zajmujących się genetyką laboratoriów na świecie (zob. hasła geny homeotyczne, homeoza, antennapedia(ang.), bithorax i in.)[8][9].
Za przełomowe uważa się odkrycie rodziny genów regulatorowych (zob. sekwencja regulatorowa genu), która jest prawdopodobnie wspólna dla wszystkich zwierząt, również człowieka[8][9] (zob. np. gen „p53” odpowiedzialny za hamowanie rozwoju nowotworów).
Dziedziczenie mutacji białych oczu (T.H. Morgan, 1919)
Geny homeotyczne kompleksów ANT-C i BX-C
Przykład mutacji w kompleksie ANT-C (antennapedia(ang.))
Wywilżna karłowata, drozofila karłówka, muszka owocowa, wywilżnia, wywilżanka, drozofila, octówka (Drosophila melanogaster) – niewielki owad (wielkości 2–3 mm) z rzędu muchówek. Jest gatunkiem należącym do bezkręgowych organizmów modelowych. Został użyty przez Thomasa Morgana w badaniach nad chromosomową teorią dziedziczności. Owad ten jest też jednym z pierwszych zwierząt wykorzystywanych w bioastronautyce – od 1952 w lotach balonowych w górne warstwy atmosfery – i pierwszym zwierzęciem umieszczonym przez ludzi w przestrzeni kosmicznej (20 lutego 1947).
W środowisku naturalnym owady te spotkać można w pobliżu drzew owocowych, wokół fermentujących owoców, ale przywabiają je także zapachy produktów jak wino, konfitury, dżemy i ocet. Nazwa muszka owocowa pochodzi stąd, iż owady te odżywiają się drożdżami żyjącymi na gnijących owocach. Nie jest więc szkodnikiem upraw rolnych, choć może powodować szkody w przetworach owocowych.
Drosophila melanogaster é uma espécie de mosca (ordem taxonômica Diptera) na família Drosophilidae. A espécie também é conhecida como mosca-das-frutas ou mosca-do-vinagre.[2]
A espécie é amplamente utilizada como um organismo modelo, principalmente em pesquisas de genética.[3] A espécie é normalmente utilizada em pesquisas devido ao seu ciclo de vida rápido, genética relativamente simples com apenas quatro pares de cromossomos e grande número de descendentes por geração.[4] Era originalmente uma espécie africana, com todas as linhagens não-africanas tendo uma origem comum.[5] Sua distribuição geográfica inclui todos os continentes, incluindo ilhas.[3] D. melanogaster é uma praga comum em casas, restaurantes e outros lugares onde a comida é servida.[6]
As moscas pertencentes à família Tephritidae também são chamadas de "moscas da fruta". Isso pode causar confusão, pois os tefritídeos são pragas que causam prejuízo aos fruticultores. As drosófilas se alimentam de leveduras em frutos já caídos em início de decomposição e, portanto, não causam prejuízo.
A forma selvagem de D. melanogaster possui o corpo amarelo-acastanhadas, com olhos vermelho e anéis transversais pretos no abdômen. A cor dos olhos do tipo selvagem deve-se a dois pigmentos: xantomantina,[7] que é marrom e derivada do triptofano, e drosopterinas, que são vermelhas e derivadas do trifosfato de guanosina.[8]
Apresentam dimorfismo sexual; as fêmeas têm cerca de 2,5 mm de comprimento; os machos são ligeiramente menores com o dorso mais escuro. Os machos são facilmente distinguidos das fêmeas. Os machos apresentam uma mancha preta na extremidade do abdômen, devido à fusão dos segmentos terminais. Possuem uma estrutura pilosa, denominada "pente sexual", na base do metatarso do par de patas anterior.[9] Além disso, os machos têm um aglomerado de pêlos pontiagudos (grampos) ao redor das partes reprodutoras usadas para se prender à fêmea durante o acasalamento. As fêmeas apresentam listas claras e escuras nos segmentos abdominais e não possuem qualquer estrutura pilosa nas patas.
A duração média do ciclo de vida de D. melanogaster depende das condições ambientais. Em condições ideais de crescimento, a 25°C, o tempo de vida de melanogaster é de cerca de 50 dias, do ovo à morte.[10] O período de desenvolvimento de D. melanogaster varia com a temperatura, como em muitas espécies ectotérmicas. O menor tempo de desenvolvimento (ovo a adulto), 7 dias, é alcançado a 28°C.[11][12]
Os tempos de desenvolvimento aumentam em temperaturas mais altas (11 dias em 30°C) devido ao estresse térmico. Em condições ideais, o tempo de desenvolvimento a 25°C é de 8,5 dias, a 18°C leva 19 dias, e a 12°C leva mais de 50 dias.[11][12] Em condições de superlotação, o tempo de desenvolvimento aumenta,[13] enquanto as moscas emergentes são menores.[13][14]
Fêmeas depositam cerca de 400 ovos, cinco de cada vez, em frutas podres ou outros materiais adequados, como fungos em decomposição e fluxos de seiva. Drosophila melanogaster é um inseto holometabólico, sofrendo uma metamorfose completa. Seu ciclo de vida é dividido em 4 fases: embrião, larva, pupa, adulto.[15] Os ovos, que medem cerca de 0,5 mm, eclodem em 12 a 15 horas (a 25°C). As larvas resultantes crescem por 4 dias (a 25°C) com duas mudas (no 2º e 3º estágio larval), em aproximadamente 24 a 48 horas após a eclosão. Durante esse tempo, se alimentam dos microrganismos que decompõem a fruta, assim como dos açúcares da fruta. A mãe coloca fezes nas bolsas de ovos para estabelecer a mesma composição microbiana no intestino das larvas.[16] As larvas então encapsulam no pupário e passam por uma metamorfose (a 25°C) por quatro dias, após os quais os adultos emergem da pupa.[11][12]
Os machos executam uma sequência de cinco padrões de comportamento para cortejar as fêmeas. Primeiro, os machos se orientam enquanto produzem uma "canção" de cortejo, abrindo suas asas horizontalmente e fazendo-as vibrar. Pouco depois, o macho posiciona-se na parte de trás do abdômen da fêmea em uma postura baixa para dar tapinhas e lamber os genitais da fêmea. Finalmente, o macho dobra o abdômen e tenta a cópula. As fêmeas podem rejeitar os machos afastando-se deles, chutando-os e expulsando seu ovipositor.[17]
A cópula dura de 15 a 20 minutos,[18] durante o qual os machos transferem para a fêmea algumas centenas de espermatozoides muito longos (1,76 mm) no fluido seminal.[19] As fêmeas armazenam o esperma em um receptáculo tubular e em dois espermatecas em forma de cogumelo, onde espermatozoides de muitos cruzamentos competem pela fertilização. Acredita-se que exista uma última precedência masculina; o último macho a acasalar com uma fêmea reproduz cerca de 80% de sua prole. Essa precedência ocorre por meio dos mecanismos chamados de deslocamento e incapacitação.[20] O deslocamento é atribuído ao manuseio do esperma pela fêmea, à medida que ocorrem os vários acasalamentos, e é mais significativo durante os primeiros 1 ou 2 dias após a cópula. O deslocamento do receptáculo seminal é mais significativo do que o deslocamento do espermateca..[20] A incapacitação do espermatozoide do primeiro macho pelo espermatozoide do segundo macho é significativa de 2 a 7 dias após a cópula. Acredita-se que o fluido seminal do segundo macho seja responsável por esse mecanismo de incapacitação (sem a remoção do primeiro espermatozoide masculino), que tem efeito antes da fertilização ocorrer.[20]
Acredita-se que o atraso na eficácia do mecanismo de incapacitação seja um mecanismo de proteção que evita que uma mosca macho incapacite seu próprio esperma, caso acasale repetidamente com a mesma mosca fêmea. Neurônios sensoriais no útero de D. melanogaster fêmeas respondem a uma proteína masculina que é encontrada no sêmen. Esta proteína torna a fêmea relutante em copular por cerca de 10 dias após a inseminação. O sinal é enviado a uma região do cérebro que é homóloga do hipotálamo e o hipotálamo controla então o comportamento sexual e o desejo. Hormônios gonadotrópicos em Drosophila mantêm a homeostase e governam a produção reprodutiva por meio de uma inter-relação cíclica, não muito diferente do ciclo estral dos mamíferos.[21]
D. melanogaster foi um dos primeiros organismos usados para análises genéticas, e hoje é um dos organismos mais amplamente usados e geneticamente conhecidos de todos os eucariotos. Todos os organismos usam sistemas genéticos comuns; portanto, compreender processos gerais como a transcrição e replicação do DNA em moscas-das-frutas ajuda a entender esses processos em outros eucariotos, incluindo humanos. A espécie também tem importância na pesquisa ambiental e mutagênese.
Thomas Hunt Morgan começou a usar moscas de fruta em estudos experimentais de hereditariedade em 1910, em um laboratório conhecido como "Fly Room" (sala da mosca). Essa sala era ocupada por oito mesas, nas quais os alunos faziam seus experimentos. Alguns dos experimentos mais importantes da história da biologia foram realizados lá. Morgan e seus alunos elucidaram muitos princípios básicos de hereditariedade, incluindo herança ligada ao sexo, epistasia, alelos múltiplos e mapeamento genético.[22]
Existem muitos motivos pelos quais a mosca da fruta é uma escolha popular como organismo modelo:
Os marcadores genéticos são comumente usados em pesquisas com drosófilas, e a maioria dos fenótipos são facilmente identificáveis a olho nu ou com um microscópio. Na lista de exemplos de marcadores comuns abaixo, o símbolo do alelo (em inglês) é seguido pelo nome dos genes afetados e a descrição de seu fenótipo. (Observação: os alelos recessivos são escritos em letras minúsculas, enquanto os alelos dominantes são escritos em letras maiúsculas.)
Os genes de Drosophila são tradicionalmente nomeados devido ao fenótipo que causam quando sofrem mutação. Por exemplo, a ausência de um determinado gene em Drosophila resultará em um embrião mutante que não desenvolve o coração; os cientistas nomearam o gene de tinman (Homem de Lata, a partir do personagem de The Wonderful Wizard of Oz, que não tinha coração).[28] Este sistema de nomenclatura compreende um número maior de nomes de genes do que em outros organismos.
O genoma de D. melanogaster (sequenciado em 2000)[27] contém quatro pares de cromossomos - um par X/Y e três autossomos rotulados 2, 3 e 4. O quarto cromossomo é tão minúsculo, que muitas vezes é ignorado, com exceção de seu importante gene eyeless (sem olhos). O genoma sequenciado de D. melanogaster possui 139,5 milhões de pares de bases,[29] e contém cerca de 15.682 genes de acordo com a versão 73 do Ensemble. Mais de 60% do genoma parece ser DNA funcional não-codificador de proteínas, envolvido em controle da expressão gênica.[30]
A determinação do sexo em Drosophila ocorre pela proporção de cromossomos X em relação aos autossomos,[31] não pela presença ou ausência de um cromossomo Y, como na determinação sexual humana. Embora o cromossomo Y seja totalmente heterocromático, ele contém pelo menos 16 genes, muitos dos quais têm funções relacionadas ao sexo masculino.[32]
Um estudo publicado em março de 2000, realizado pelo National Human Genome Research Institute, comparou o genoma da Drosophila melanogaster com o genoma humano, e estimou que cerca de 60% dos genes são conservados entre as duas espécies. Cerca de 75% dos genes de doenças humanas conhecidas têm uma correspondência reconhecível no genoma da espécie. A Drosophila está sendo usada como um modelo genético para várias doenças humanas, incluindo doenças neurodegenerativas como Parkinson, Huntington, ataxia espinocerebelar e doença de Alzheimer. A mosca também está sendo usada para estudar mecanismos subjacentes ao envelhecimento e estresse oxidativo, imunidade, diabetes e câncer, bem como abuso de drogas.[33][34][35]
Drosophila melanogaster tem sido amplamente estudada na área da biologia do desenvolvimento. Seu pequeno tamanho, curto tempo de geração e numerosos descendentes a tornam ideal para estudos genéticos e embriológicos. Os trabalhos com Drosophila têm proporcionado a elucidação de processos biológicos envolvidos no estabelecimento dos eixos corporais (dorso-ventral e antero-posterior), formação da linhagem germinativa e do controle da expressão gênica envolvida nesses processos.
Cada folículo ovariano de Drosophila é constituído por 16 células germinativas conectadas por canais em anel. Duas dessas células adquirem quatro canais de comunicação e são denominadas de pró-ovócitos, e por competição somente uma terminará a meiose I e será o futuro ovócito. As demais 15 células se tornarão nutridoras poliploides, que se especializam em transcrever RNAs mensageiros importantes para o futuro desenvolvimento embrionário.[36] A localização assimétrica dos mRNAs especifica os eixos corporais e permite o estabelecimento de gradientes morfógenos de proteínas, que determinam o destino celular durante a fase inicial do desenvolvimento. Estes mRNAs codificam proteínas envolvidas na regulação da transcrição e da tradução, que se difundem pela blastoderme sincicial levando à ativação ou repressão de genes zigóticos. Então, durante a formação do ovócito são transcritos genes codificadores de fatores maternos, e os seus mRNA são posicionados em determinadas regiões deste ovócito. Após a fecundação, estes mRNA são traduzidos em proteínas que ocuparão o mesmo lugar no zigoto.
Após a fertilização do ovócito pelo espermatozoide, o embrião inicial (ou embrião sincicial) sofre uma rápida replicação do ADN, ocorrendo 13 divisões nucleares até que aproximadamente 5.000 a 6.000 núcleos se acumulam no citoplasma comum não dividido do embrião. Ao final da 8ª divisão, a maioria dos núcleos migraram à superfície, circundando o saco vitelino (deixando para trás apenas alguns núcleos, que se transformarão em núcleos vitelinos). Após a 10ª divisão, células polares se formam na extremidade posterior do embrião, secretando a linha germinal do sincício. Finalmente, após a 13ª divisão, as membranas celulares invaginam-se lentamente, dividindo o sincício em células somáticas individualizadas. Uma vez que se completa este processo, a gastrulação se inicia.[37]
A divisão nuclear no embrião inicial da Drosophila ocorre tão rapidamente que não há pontos de verificação verdadeiros, portanto, podem ocorrer erros na divisão do DNA. Para resolver esse problema, os núcleos nos quais algum erro foi cometido se separam de seus centrossomas e caem para o centro do embrião (o saco vitelino), que não fará parte da mosca.
A rede gênica (interação transcricional e proteica) que direciona o desenvolvimento inicial do embrião da mosca-das-frutas é uma das mais conhecidas hoje, especialmente os padrões ao longo dos eixos anteroposterior (AP) e dorsoventral (DV). Os eixos corporais são estabelecidos logo no início do desenvolvimento pela distribuição assimétrica de determinantes (transcritos de regiões específicas) no citoplasma do ovo. O desenvolvimento do embrião dependerá de fatores gerados pela mãe durante a ovogênese e de processos que ocorrem durante o desenvolvimento ovariano.
O embrião sofre movimentos morfogenéticos bem caracterizados durante a gastrulação e desenvolvimento inicial, como extensão germinativa, formação de vários sulcos, invaginação ventral do mesoderma, invaginação posterior e anterior do endoderma (trato digestivo) e extensa segmentação do corpo. até que finalmente eclode na cutícula circundante e passe para o 1º estágio larval. Durante o desenvolvimento larval, tecidos chamados discos imaginários crescem dentro da larva. Os discos imaginários se desenvolvem para formar a maioria das estruturas do corpo adulto, como cabeça, pernas, asas, tórax e genitais. As células do disco imaginário são estacionadas ou paradas momentaneamente durante a embriogênese, mas continuam a crescer e se dividir durante os estágios larvais, ao contrário da maioria das outras células larvais, que se diferenciaram para desempenhar funções especializadas e crescer para experimentar mais divisões celulares. Na metamorfose , a larva forma uma pupa, dentro da qual os tecidos larvais são reabsorvidos e os tecidos imaginários sofrem extensos movimentos morfogenéticos para formar as estruturas adultas.
As moscas Drosophila têm cromossomos X e Y, bem como autossomos. No entanto, ao contrário dos humanos, o cromossomo Y não confere masculinidade; em vez disso, codifica os genes necessários para a produção de esperma. O sexo é determinado pela proporção de cromossomos X para autossomos.[38] Além disso, cada célula "decide" se será masculina ou feminina independentemente do resto do organismo, resultando na ocorrência ocasional de ginandromorfos.
O desenvolvimento do fenótipo sexual em Drosophila é mediado por uma série de genes. Três genes principais estão envolvidos na determinação sexual em Drosophila. Estes são: sex-lethal, sisterless, and deadpan. Deadpan é um gene autossômico que inibe o gene sex-lethal,[39] enquanto sisterless é um gene ligado ao cromossomo X,[40] e inibe a ação de deadpan.
Uma célula AAX possui duas vezes mais deadpan do que sisterless, então sex-lethal será inibido, gerando um macho. No entanto, uma célula AAXX possuirá sisterless o suficiente para inibir a ação de deadpan, permitindo que o gene sex-lethal seja transcrito, gerando uma fêmea.
Mais tarde, o controle pelos genes deadpan e sisterless desaparece, e o que se torna importante é a forma do gene sex-lethal. Um promotor secundário é ativado, e esse gene é transcrito tanto em machos como em fêmeas. Porém, a análise de cDNA mostrou que diferentes formas são expressas em machos difere daquele das fêmeas. Foi demonstrado que a sex-lethal afeta o splicing de seu próprio mRNA.
Em machos, o transcrito nuclear é emendado de uma maneira que fornece três éxons, e o códon de terminação está no interior do éxon central. Em fêmeas, a presença do sex-lethal faz com que o processamento de RNA forneça apenas dois éxons, e o éxon central específico de macho está agora externalizado como um grande íntron. Assim, o mRNA específico de fêmea carece do códon de terminação; os outros sete aminoácidos são produzidos como uma cadeia peptídica completa, novamente dando uma diferença entre machos e fêmeas.[41]
A presença ou ausência de proteínas sex-lethal funcionais agora vai afetar a transcrição de outra proteína conhecida como doublesex. In the absence of sex-lethal, doublesex will have the fourth exon removed and be translated up to and including exon 6 (DSX-M[ale]), while in its presence the fourth exon which encodes a stop codon will produce a truncated version of the protein (DSX-F[emale]). DSX-F causes transcription of Yolk proteins 1 and 2 in somatic cells, which will be pumped into the oocyte on its production.
Diferente de mamíferos, a Drosophila possui somente imunidade inata e carece de uma resposta imune adaptativa. O sistema imunitário da D. melanogaster pode ser realizar duas respostas imunes: humoral e mediada por células. A primeira é uma resposta sistêmica mediada em grande parte pelas vias de sinalização Toll e Immune defficiency (Imd).[42] A via Imd atua contra bactérias gram-negativas e a via Toll contra bactérias gram-positivas, vírus e fungos, as quais desencadeiam a produção dos peptídeos antimicrobianos locais e sistêmicos.[43] Outras vias estão envolvidas nas principais respostas fisiológicas à infecção, incluindo as vias de resposta ao estresse JAK-STAT e P38, sinalização nutricional via FOXO e sinalização de morte celular JNK.
D. melanogaster tem um "corpo gordo" análogo ao do fígado humano. O corpo gordo é o principal órgão secretor, que produz moléculas imunológicas essenciais após a infecção, como peptídeos antimicrobianos (AMPs). Esses peptídeos são secretados na hemolinfa e se ligam a bactérias e fungos infecciosos, matando-os pela formação de poros em suas paredes celulares ou inibindo processos intracelulares. Além do corpo gordo, a resposta imune celular se refere à atividade direta das células sanguíneas, os hemócitos, que são análogas aos monócitos/macrófagos de mamíferos e desempenham um papel significativo nas respostas imunológicas. Em resposta aos desafios imunológicos, os hemócitos podem secretar citocinas, para ativar as vias de sinalização a jusante no corpo gordo. No entanto, o mecanismo por trás disso ainda não está claro.[44]
A primeira descrição de receptores do tipo Toll envolvidos na resposta à infecção foi realizada em Drosophila,[45] culminando em um prêmio Nobel em 2011.[46] A via Toll em Drosophila é homóloga às vias Toll-like em mamíferos. A via Toll foi descrita como sendo a principal via de defesa contra fungos, bactérias gram-positivas e vírus em Drosophila.[47]
Essa cascata regulatória é iniciada após o reconhecimento do patógeno por receptores de reconhecimento de padrões (RRPs). Os receptores do tipo Toll não conseguem reconhecer diretamente o patógeno; para serem ativados, necessitam da presença de uma proteína ligante, o peptídeo Spätzle (Spz). Após uma infecção, a proteína precursora pró-Spätzle é clivada pela protease SPE (enzima do processador Spätzle) e dá origem ao Spätzle ativo, que então se liga ao receptor Toll, localizado na superfície da célula do corpo gordo, e se dimeriza para ativar vias de sinalização de NF-kB a jusante, incluindo múltiplos "domínios de morte" contendo proteínas e reguladores negativos, como a proteína de repetição de anquirina Cactus. A via culmina com a translocação dos fatores de transcrição NF-κB Dorsal e Dif (fator de imunidade relacionado ao dorso) para o núcleo.
A via Imd é ortóloga à superfamília de receptores do fator de necrose tumoral humano e é desencadeada por bactérias Gram-negativas através do reconhecimento por proteínas de reconhecimento de peptidoglicano (PGRP), incluindo receptores de superfície (PGRP-LR) e solúveis (LC). A sinalização de Imd culmina na translocação do fator de transcrição NF-κB para o núcleo, levando à regulação positiva de genes responsivos a Imd, incluindo a diptericina AMP. Consequentemente, as moscas deficientes em AMPs se assemelham aos mutantes da via Imd em termos de suscetibilidade à infecção bacteriana.
A via de sinalização JAK/STAT consiste em três componentes principais: um receptor de superfície celular, uma Janus quinase (JAK) e o fator de transcrição STAT.[48] Vários elementos da via de sinalização JAK-STAT de Drosophila apresentam homologia direta com os genes da via JAK-STAT humana. A sinalização JAK-STAT é induzida por vários fatores estressores do organismo, como calor, desidratação ou infecção. A indução JAK-STAT leva à produção de uma série de proteínas de resposta ao estresse, incluindo proteínas contendo tioéster (TEPs),[49] Turandots,[50] e o peptídeo antimicrobiano putativo Listericina.[51] Os mecanismos pelos quais muitas dessas proteínas atuam ainda estão sob investigação. Por exemplo, os TEPs parecem promover a fagocitose de bactérias Gram-positivas e a indução da via Toll. Como consequência, as moscas sem TEPs são mais suscetíveis à infecção.[49]
Os hemócitos circulantes são os principais reguladores da infecção. Isso foi demonstrado tanto por meio de ferramentas genéticas para gerar moscas sem hemócitos, quanto por meio da injeção de gotículas lipídicas, que saturam a capacidade do hemócito de fagocitar uma infecção secundária.[52][53] As moscas tratadas assim não conseguem fagocitar as bactérias após a infecção e são correspondentemente suscetíveis à infecção.[54] Esses hemócitos derivam de duas ondas de hematopoiese, uma ocorrendo no embrião inicial e outra ocorrendo durante o desenvolvimento da larva ao adulto.[55] No entanto, os hemócitos de Drosophila não se renovam ao longo da vida adulta e, portanto, a mosca tem um número finito de hemócitos que diminui ao longo de sua vida.[56] Os hemócitos também estão envolvidos na regulação de eventos do ciclo celular e apoptose de tecido aberrante (por exemplo, células cancerosas), produzindo Eiger, uma molécula sinalizadora do fator de necrose tumoral que promove asinalização JNK e, em última instância, a morte celular e a apoptose.[57]
Drosophila melanogaster é uma espécie de mosca (ordem taxonômica Diptera) na família Drosophilidae. A espécie também é conhecida como mosca-das-frutas ou mosca-do-vinagre.
A espécie é amplamente utilizada como um organismo modelo, principalmente em pesquisas de genética. A espécie é normalmente utilizada em pesquisas devido ao seu ciclo de vida rápido, genética relativamente simples com apenas quatro pares de cromossomos e grande número de descendentes por geração. Era originalmente uma espécie africana, com todas as linhagens não-africanas tendo uma origem comum. Sua distribuição geográfica inclui todos os continentes, incluindo ilhas. D. melanogaster é uma praga comum em casas, restaurantes e outros lugares onde a comida é servida.
As moscas pertencentes à família Tephritidae também são chamadas de "moscas da fruta". Isso pode causar confusão, pois os tefritídeos são pragas que causam prejuízo aos fruticultores. As drosófilas se alimentam de leveduras em frutos já caídos em início de decomposição e, portanto, não causam prejuízo.
Drosophila melanogaster (grecescul pentru „Iubitorul de rouă cu burtă neagră” δρόσος = rouă, φίλος = iubitor, μέλας = colorat în negru, γαστήρ = burtă [2]) este o specie de diptere din ordinul muștelor, din familia Drosophilidae. Specia este tradițional cunoscută ca musculița de oțet sau simplu drosofila. Începând cu propunerea lui Charles W. Woodworth de a utiliza această specie ca organism model, D. melanogaster a continuat să fie utilizată pe larg pentru cercetarea biologică în studiul geneticii, fiziologiei, patgenezei microbiale și a istoriei apariției vieții. Este utilizată tipic pentru că este o specie care nu necesită multă mâncare, se înmulțește repede (o generație are 12 zile), este prolifică (depune foarte multe ouă) și larvele prezintă cromozomi politeni (uriași).[3]
Drosophila melanogaster (grecescul pentru „Iubitorul de rouă cu burtă neagră” δρόσος = rouă, φίλος = iubitor, μέλας = colorat în negru, γαστήρ = burtă ) este o specie de diptere din ordinul muștelor, din familia Drosophilidae. Specia este tradițional cunoscută ca musculița de oțet sau simplu drosofila. Începând cu propunerea lui Charles W. Woodworth de a utiliza această specie ca organism model, D. melanogaster a continuat să fie utilizată pe larg pentru cercetarea biologică în studiul geneticii, fiziologiei, patgenezei microbiale și a istoriei apariției vieții. Este utilizată tipic pentru că este o specie care nu necesită multă mâncare, se înmulțește repede (o generație are 12 zile), este prolifică (depune foarte multe ouă) și larvele prezintă cromozomi politeni (uriași).
Drozofila obyčajná alebo aj vínna a ovocná muška[1] (Drosophila melanogaster) je druh muchy z čeľade drozofilovité. S ľuďmi zdieľa až 60% DNA. Za výskum s drozofilou (hlavne Drosophila melanogaster, ale aj s inými druhmi) bolo do roku 2018 udelených osem Nobelových cien.[2][3]
Bola prvým živočíchom vo vesmíre. 20. februára 1947 Američania vypustili raketu V2 z White Sands Missile Range. Drozofila bola použitá na skúmanie pôsobenia žiarenia vo veľkých výškach.[4]
Pôvodom je z tropickej západnej Afriky[5] (iný zdroj uvádza centrálnu Afriku[6]). Je ľudský komenzál, čo je dôvod jej rozšírenia po celom svete. Vyvinuli sa približne pred 3,4 miliónmi rokov.[6]
Má žltohnedú farbu a červené oči (môžu mať hnedé oči alebo aj žiadne[7]). Bruško má čierne priečne pruhy. U tohto druhu je prítomný sexuálny dimorfizmus, samica je veľká 2,5 mm, samec je menší a má tmavšie bruško.
Muška kladie vajíčka hlavne do hnijúceho ovocia, vína, piva, octu a ďalších kvasiacich látok[8]. Žijú aj v rozkladajúcich sa hubách, kaktusoch aj zdochlinách.[7] Niekedy sú zodpovedné aj za prenos hubových ochorení na rastliny.[7] Väčšinou netrpia chorobami, v laboratóriu však môžu mať problémy s roztočmi, hubami alebo baktériami.[9]
Je to holometabolný hmyz. Vývoj je ovplyvnený teplotou pri 18 °C 19 dní, pri 29 °C 9 dní od vajíčka po dospelého.[9] Dospelé jedince žijú v priemere 45 dní, maximálne 80 dní. Môžu sa páriť 10 hodín po premene na imágo[9]. Samica dokáže za život naklásť až 2 000 vajíčok.[10] Larvy po vyliahnutí požierajú kvasnice a baktérie. Má tri larválne štádia do kukly. Po zakuklení sa dospelí jedinec objaví za cca 4 dni.
Samice výrazne preferujú rozmnožovanie so svojimi bratmi. Navyše, samice sa nevyhýbajú páreniu so svojimi otcami a samce sa nevyhýbaju páreniu so svojimi sestrami, čo podporuje príbuzenské rozmnožovanie.[11]
Už viac ako storočie[12] slúži drozofila obyčajná ako modelový organizmus vo viacerých výskumoch, hlavne v molekulárnej a evolučnej biológii, genetike[5], neurovede[12]. Je malá s krátkym a lacným životným cyklom, má iba štyri páry chromozómov a kladie veľa vajíčok, preto je veľmi vhodná na výskum.[10] Jej genóm je ľahko manipulovateľný pomocou rôznych genetických techník.[5]
S výskumom ako prvý začal pravdepodobne T. H. Morgan, keď v roku 1910 vznikol pri výskume dedičnosti prvý mutant s bielymi očami. Jeho študent Alfred Sturtevant v roku 1913 vytvoril prvú genetickú mapu, kde demonštroval lineárne radenie génov.[13] Morgan preukázal, že genetická informácia sa prenáša pomocou chromozómov, za čo získal v roku 1933 Nobelovu cenu.[14] Hermann Joseph Muller (tiež Morganov študent[15]) v roku 1927 experimentoval s vplyvom röntgenového žiarenia na dedičnosť. Zistil, že u múch, ktoré boli tomuto žiareniu vystavené sa zvýšilo množstvo mutácii. Neskôr v roku 1946 za svoj výskum získal Nobelovu cenu. George Wells Beadle a Edward Lawrie Tatum 1958 dostali Nobelovu cenu za výskum génov. Max Delbrück, Alfred D. Hershey a Salvador E. Luria použili drozofilu na výskum v oblasti mechanizmov replikácie a genetiky vírusov, čo im prinieslo Nobelovu cenu. V roku 1995 bola udelená ďalšia Nobelova cena, Edward B. Lewis, Christiane Nüssleinová-Volhardová a Eric F. Wieschaus ju získali za svoj objav týkajúci sa genetického ovládania skorého embryonálneho vývoja drozofily.[16] a na svoj výskum použili práve drozofilu obyčajnú. V roku 2000 bol jej kompletný genóm sekvenovaný.[17]
Drozofila obyčajná alebo aj vínna a ovocná muška (Drosophila melanogaster) je druh muchy z čeľade drozofilovité. S ľuďmi zdieľa až 60% DNA. Za výskum s drozofilou (hlavne Drosophila melanogaster, ale aj s inými druhmi) bolo do roku 2018 udelených osem Nobelových cien.
Bola prvým živočíchom vo vesmíre. 20. februára 1947 Američania vypustili raketu V2 z White Sands Missile Range. Drozofila bola použitá na skúmanie pôsobenia žiarenia vo veľkých výškach.
Drosophila melanogaster (dobesedno grško ljubiteljica rose s temnim trebuhom) je majhna muha iz družine vinskih mušic. Samice merijo 2,5 mm, samci pa so nekoliko manjši. V naravi imajo opečnato rdeče oči in rjavkasto-rumeno telo s prečnimi obroči temne barve preko zadka. Vrstno ime je dobila po lastnosti samcev, da imajo na hrbtni strani temno obarvano konico zadka, s čemer jih je mogoče enostavno ločiti od samic.
Imajo izredno hiter razvojni krog. Življenjska doba je močno odvisna od temperature in znaša 8,5 dni v idealnih pogojih (25 °C). Samica izleže okrog 400 jajčec naenkrat, skupaj v času svojega življenja do 2000. Izleže jih v odmirajoč les, gnijoče sadje ali gobe oz. podobne substrate. Ličinke se izležejo po 12 do 15 urah. Rastejo približno 4 dni in se medtem dvakrat levijo, nato pa zabubijo in preobrazijo v odraslo žival. Samica se prične odzivati na dvorjenje 8–12 ur po tem in se lahko prične pariti.[2][3]
Vrsta je doživela slavo z delom biologa Thomasa Hunta Morgana (1833–1945). Muha je zelo primerna za raziskave dednosti, mutacij in prilagoditve na življenjsko okolje iz več razlogov:
Na modelu te vrste so raziskovalci iz Morganovega laboratorija najprej potrdili Mendlove principe dedovanja nevezanih lastnosti, nato pa so se lotili kompleksnejših pojavov. Kmalu so jih pričeli gojiti in preučevati tudi v drugih vodilnih laboratorijih in danes je D. melanogaster najbolj preučevan evkariotski organizem. Celoten genom je znan od leta 2000.[4] Enostavno gojenje in možnost kontroliranega uvajanja mutacij omogoča preučevanje tudi mnogih drugih procesov – embriološkega razvoja, vedenja, fiziologije, evolucije idr.
Drosophila melanogaster (dobesedno grško ljubiteljica rose s temnim trebuhom) je majhna muha iz družine vinskih mušic. Samice merijo 2,5 mm, samci pa so nekoliko manjši. V naravi imajo opečnato rdeče oči in rjavkasto-rumeno telo s prečnimi obroči temne barve preko zadka. Vrstno ime je dobila po lastnosti samcev, da imajo na hrbtni strani temno obarvano konico zadka, s čemer jih je mogoče enostavno ločiti od samic.
Imajo izredno hiter razvojni krog. Življenjska doba je močno odvisna od temperature in znaša 8,5 dni v idealnih pogojih (25 °C). Samica izleže okrog 400 jajčec naenkrat, skupaj v času svojega življenja do 2000. Izleže jih v odmirajoč les, gnijoče sadje ali gobe oz. podobne substrate. Ličinke se izležejo po 12 do 15 urah. Rastejo približno 4 dni in se medtem dvakrat levijo, nato pa zabubijo in preobrazijo v odraslo žival. Samica se prične odzivati na dvorjenje 8–12 ur po tem in se lahko prične pariti.
Vrsta je doživela slavo z delom biologa Thomasa Hunta Morgana (1833–1945). Muha je zelo primerna za raziskave dednosti, mutacij in prilagoditve na življenjsko okolje iz več razlogov:
je nezahtevna za gojenje in se brez težav razmnožuje v laboratoriju hiter generacijski čas omogoča preučevanje mnogih generacij v danem času v celicah žlez slinavk ima orjaške kromosome z jasno vidnimi regijami, kjer se dogaja prepisovanje genov fenotipsko izražanje genskih znakov je enostavnejše kot pri denimo sesalcihNa modelu te vrste so raziskovalci iz Morganovega laboratorija najprej potrdili Mendlove principe dedovanja nevezanih lastnosti, nato pa so se lotili kompleksnejših pojavov. Kmalu so jih pričeli gojiti in preučevati tudi v drugih vodilnih laboratorijih in danes je D. melanogaster najbolj preučevan evkariotski organizem. Celoten genom je znan od leta 2000. Enostavno gojenje in možnost kontroliranega uvajanja mutacij omogoča preučevanje tudi mnogih drugih procesov – embriološkega razvoja, vedenja, fiziologije, evolucije idr.
Bananfluga (Drosophila melanogaster) är en flugart som ingår i släktet Drosophila och familjen daggflugor (Drosophilidae). Arten beskrevs av Johann Wilhelm Meigen år 1830.[2][3][4] Bananflugan är ett mycket vanligt skadedjur som finns över hela världen i närhet till ruttnande frukt eller människans matavfall. Bananflugan är en av de mest använda modellorganismerna inom biologin, den används i dag i mycket stor skala i ett stort antal av olika forskningsfält och har historiskt använts för mycket av den viktigaste och grundläggande forskningen inom genetiken.[5] Bananflugan används också som levandefoder för sällskapsdjur.
Namnet Bananfluga kommer av att den ofta påträffas vid frukt. Ibland används ordet "fruktflugor", vilket är en felaktig direktöversättning av det engelska ordet "fruit flies" (bananflugor). "Fruktflugor" är olämpligt eftersom det även kan beteckna borrflugor (Tephritidae). Helt felaktigt är att kalla dem "blomflugor", vilket är namnet på medlemmar i familjen Syrphidae.
Det vetenskapliga namnet Drosophila melanogaster är grekiska för "mörkbukad dagg-älskare" (δρόσος = 'dagg', φίλος = 'intim vän', 'älskare', μέλας = 'mörkfärgad', γαστήρ = 'mage').
Likt övriga tvåvingar genomgår bananflugan en fullständig metamorfos, detta innebär att den utvecklas från ägg, till larv, puppa och till sist når det fullvuxna stadiet som hos insekter kallas imago. Livscykelns längd varierar till en viss grad beroende på omgivningen, och framförallt temperaturen. Nedan följer ungefärliga tidslängder för de olika stadierna vid 22 °C. Vid 18 °C tar utvecklingen ungefär dubbelt så lång tid.[6][5] Både larverna och de vuxna individerna hittas vid ruttnande frukt, matrester eller liknande, där äter de jäst, mögel och bakterier som växer på det ruttnande materialet, i viss mån får de även näring från det ruttnande materialet i sig självt.[7][8]
Äggen hos bananflugan läggs normalt i ruttnande frukt. Äggen är avlånga, vita, möjligtvis något gulaktiga och ca 0,5 mm långa. Utstickande från äggen är två stycken utskott, dessa används för att förse ägget med luft. Detta behövs då äggen ofta är begravda strax under ytan på det substrat som äggen lagts i. Äggen kläcks ungefär en dag efter att de lagts.[6]
Larvstadiet delas upp i tre olika stadier. Första och andra larvstadierna är ca 1 dag långa. Tredje larvstadiet är ca 2 dagar långt.[5] I slutet av det tredje larvstadiet så kryper larven ofta ut ur maten och försöker hitta en bra plats för att förpuppa sig.[6] Larven är vit, förutom munnen som är svart.
Stadiet som puppa är hos bananflugan ca 4-5 dagar långt.[6][5]
Vuxenstadiet hos insekter, kallat imago, når bananflugan ca 11-12 dagar efter att den lagts som ägg. Honan blir sexuellt mogen efter 8-10 timmar.[6] Livslängden varierar beroende på omgivningen, men är ungefär 30 dagar vid en temperatur av 29 °C. En hona kan lägga ca 100 ägg per dag.[6] Även honor som inte parat sig kan lägga ägg, dessa brukar dock vara få och är sterila eftersom de inte blivit befruktade.[6]
Bananflugan har ett specifikt parningsbeteende som inleds av att hannen positionerar sin kropp rakt bakom honan, om honan rör sig så cirkulerar hannen ofta runt honan. Hannen börjar sedan upprepat nudda och lätt slå på honans bakkropp, samtidigt som detta sker så börjar hannen då och då sticka ut en av sina vingar och rytmiskt vibrera denna vilket skapar en slags parningssång som kan uppfattas av honan. Denna parningssång är art-specifik och gör att bananflugan kan urskilja medlemmar från sin egen art från andra närbesläktade medlemmar av Drosophila. Efter en period på några få sekunder och upp till två minuter från att hannen initierat parningsbeteendet och så sticker hannen ut sin proboscis och slickar på honans könsorgan, direkt följt av att hannen gör ett försök till att bestiga honan. För att bestigningen skall lyckas krävs att hannen böjer bakkroppen och att honan positionerar sin bakkropp och sitt könsorgan på ett specifikt sätt. Om detta inte lyckas så avbryter hannen parningsförsöken en kort stund och börjar sedan om från början av parningsritualen.[9] Till skillnad från många andra tvåvingar så parar sig aldrig bananflugan i luften.[9]
Hos vildtypen av den vuxna bananflugan är ögonen tegelröda och kroppen i huvudsak gul-brun, med tvärgående svarta ringar runt buken. Flugorna uppvisar könsdimorfism. Honorna är cirka 2,5 millimeter långa, medan hannarna är något mindre och baksidan av deras kroppar mörkare. Hannarna har dessutom en distinkt svart fläck på bakkroppen, som dock är mindre märkbar hos individer som nyligen kläckts ur puppan. Vidare har hannarna en rad med borstliknande filament på första benparets tarser.
Bananflugan kommer ursprungligen från Afrika, från regionen nära ekvatorn, men har sedan spridits över nästan hela världen och har idag en global utbredning i miljöer kopplade till dess kommensalism med människan. Arten finns så långt norrut som Tammerfors i Finland och så långt söderut som Tasmanien i Australien. Dess spridning och moderna utbredning är en följd av att den kan föröka sig i olika typer av mänskligt avfall och på domesticerade växtarter.[10] Till Sverige kom arten någon gång efter år 1800.[3]
Bananflugan är en av de vetenskapligt allra mest studerade djurarterna och den används som modellorganism inom ett stort antal olika forskningsfält inom biologin.[11]
Anledningarna till att bananflugan används som modellorganism är flera:
Traditionellt användes bananflugan främst som modellorganism inom genetiken, där den började användas år 1907. Detta började med de experiment som gjordes av Thomas H. Morgan och andra tidiga amerikanska genetiker.[12][14] Idag används bananflugan som modellorganism i ett stort antal fält utöver genetik, som för studier av exempelvis immunförsvar[15], nanotoxicitet[16], mänskliga sjukdomar[17][18], hjärnsjukdomar[19][20], multicellulära organismer[21] och patogenicitet[22].
Thomas H. Morgans arbete under början av 1900-talet som gjordes med bananflugan gav starka bevis för att det ärftliga material som vi nu vet är DNA fanns i kromosomerna. Eftersom Morgan behövde olika varianter av bananflugan för att kunna studera ärftlighet så korsade han ett stort antal individer med varandra och undersökta avkomman mikroskopiskt i hopp om att hitta en ny variant. Efter att i många månader inte lyckats få några ny varianter så fick han till slut fram en ensam hanne med vita ögon istället för de vanliga tegelröda ögon som vildtypen har, individen hade alltså en mutation som gav dess ögon än annan färg än den vanliga. Morgan korsade sedan sin hanne med vita ögon med honor av vildtyp. Avkomman i första generationen hade bara röda ögon men i andra generationen hade en fjärdedel av individerna vita ögon, ett klassiskt tecken på att de vita ögonen var ett recessivt anlag. Utöver detta så insåg även Morgan att alla individerna med vita ögon var hannar, av detta kunde Morgan lista ut att genen för ögonfärgen måste finnas på en specifik kromosom, och att den i detta fall måste finnas på X-kromosomen men inte på Y-kromosomen.[14] Senare användes andra mutationer hos bananflugan av Morgan för att visa att vissa gener ärvs tillsammans och att detta mönster ibland bryts, vilket sker genom överkorsning.[23]
År 2000 hade i stort sett hela genomet, inklusive alla fyra kromosompar, sekvenserats[24], vilket är mycket tidigt för denna typ av storskaliga sekvensering.
Forskning kring cellodling med celler från bananflugan påbörjades under 1960-talet.[12]
Bananflugan var det första djuret i rymden. Amerikanerna sköt upp bananflugor i V2-raketer år 1946.[25]
Uppfödning sker normalt i tuber eller flaskor av glas eller plast, dessa brukar kallas odlingskulturer. När bananflugan först började användas av Thomas H. Morgan använde han mjölkflaskor av glas.[6] Bananflugan kan tillfälligt paralyseras med hjälp av eter, koldioxid eller nedkylning[6].
Bananflugan har fyra kromosompar. Genomet är cirka 165 miljoner baspar långt[5] och innehåller cirka 14000 gener.[24] Mängden DNA i en bananflugecell är 50 gånger mer än mängden i Escherichia coli, en vanlig bakteriell modellorganism, och 30 gånger mindre än hos däggdjur.[12]
Bananflugans fyra kromosompar är könskromosomerna X/Y och autosomparen 2, 3 och 4.[5] Kromosom 4 är avsevärt mindre än de andra kromosomerna, 4,2 miljoner baspar långt, och dess kromatin har egenskaper som både liknar de hos eukromatin och heterokromatin.[26]
Könskromosomernas roll för individens kön hos Drosophila fungerar annorlunda än hos människan. Hos bananflugan bestämmer antalet X-kromosomer könet, medan Y-kromosomen behövs för bildandet av spermier. Individer som har XX, två X-kromosomer, är fertila honor, de med XY är fertila hannar och de som är X0, och bara har en X-kromosom och ingen Y-kromosom, är sterila hannar.[27]
Under larvstadiet när larven växer så bildas polytena kromosomer, detta är kromosomer som replikerats likt de gör under celldelning men fortfarande sitter ihop som en lång kedja. Fullständig celldelning sker inte utan larven behåller samma antal celler samtidigt som den replikerar sitt DNA och sina kromosomer. Dessa polytena kromosomer var mycket användbara för den tidiga genetiska forskningen då dessa är så stora att de kan ses direkt med ett vanligt mikroskop. De polytena kromosomerna har också tydliga band kallade polytenband vilket gör att olika delar av kromosomen kan identifieras och vissa förändringar av kromosomen kan ses direkt i mikroskopet. Band 1-20 är X-kromosomen, band 21-60 kromosom 2, band 61-100 kromosom 3 och band 101-102 kromosom 4. Vardera av dessa band delas upp vidare i bokstavsband A-F vilket sedan vidare uppdelas i 13 delar. Detta gör att en viss position i genomet kan beskrivas, som t.ex. 42C7-9. Ett bokstavsband innehåller i genomsnitt 300 kb DNA och 15-25 gener.[5]
En av de gener som först identifierades i Drosophila är hedgehog (engelska för igelkott). Proteinet hedgehog finns hos däggdjur och är viktig för organutvecklingen, som hjärnans utveckling eller framväxten av ben och armar. När genen muteras hos bananflugan så att den blir icke funktionell får flugembryot taggar, vilket gav den dess namn.
Genen tinman (engelska för plåtman), namngiven efter Plåtmannen i Trollkarlen från Oz, specificerar hjärtats position i embryot, genens funktion är nästan identisk med funktionen hos den mänskliga homologen. Om genen är defekt så utvecklas hjärtat inte, därvid likheten med Plåtmannen i Trollkarlen från Oz som också saknar ett hjärta.[28]
Bananflugan förökar sig snabbt, och eftersom den trivs i rumstemperatur och klarar sig bra på matrester och dylikt som föda ses den ofta som ett skadedjur. Den som önskar bli av med dem i bostaden eller liknande kan med fördel blanda till ett glas med en del vatten, några droppar diskmedel, en del vinäger och två delar honung. Flugorna dras till blandningen och drunknar i den. Det enklaste sättet att bekämpa dem är dock att se till att de inte kan föröka sig, genom att inte ha gammal frukt eller dylikt tillgängligt.
Många av de egenskper som gör arten till en bra modellorganism, som att den förökar sig snabbt och är billig att föda upp, har gjort att den ofta används som levandefoder till andra djur. Den används för ytlevande akvariefiskar, mindre groddjur såsom pilgiftsgrodor och köttätande växter. När bananflugan odlas som levandefoder används ofta "vinglösa bananflugor", som har genvarianter som ger dem förkrympta vingar eller missformade vingfästen.[29] Dessa flugor kan inte flyga utan tar sig endast fram genom att gå, vilket gör handhavandet av dem enklare när de används som foder.
Bananfluga (Drosophila melanogaster) är en flugart som ingår i släktet Drosophila och familjen daggflugor (Drosophilidae). Arten beskrevs av Johann Wilhelm Meigen år 1830. Bananflugan är ett mycket vanligt skadedjur som finns över hela världen i närhet till ruttnande frukt eller människans matavfall. Bananflugan är en av de mest använda modellorganismerna inom biologin, den används i dag i mycket stor skala i ett stort antal av olika forskningsfält och har historiskt använts för mycket av den viktigaste och grundläggande forskningen inom genetiken. Bananflugan används också som levandefoder för sällskapsdjur.
Drosophila melanogaster Türkçede "sirke sineği", İngilizcede "meyve sineği (Fruit Fly)" olarak anılan iki kanatlı bir böcek türünün Latince adıdır. Moleküler genetik, gelişimsel biyoloji ve sinirbilim çalışmalarında sık sık kullanılır. Ayrıca uzaya ilk giden hayvan türüdür.
Drosophila melanogaster yüz yılı aşlın bir süredir biyoloji araştırmalarında kullanılmaktadır[1]. Sineğin küçüklüğü, kolayca çok sayıda üretilebilmesi ve bakımının ucuz olması bunda önemli rol oynar. Ayrıca yeni bir neslin 9-10 günde üretilebilmesi sayesinde deneyler nispeten hızlı ilerler. Bu nedenler, araştırmaların çok sayıda örnekle, daha az kaynak sarf ederek ve daha hızlı yapılmasına imkân sağlar.
Bunun yanı sıra yüz yıldır geliştirilmiş genetik uygulamalar da Drosophila kullanıcılarına avantajlar sağlar. Örneğin, krozomların rekombinasyonunu önleyecek çaprazlar kullanarak çaprazdan doğacak her bir sineğin genetik yapısını kestirmek mümkündür. Ayrıca, eldeki mutant ve transgenik sinekleri kullanarak herhangi bir proteinin belirli hücrelerde üretilmesini sağlamak veya engellemek de sineklerde mümkündür. Bu da belirli genlere, proteinlere ve dokulara odaklı araştırmalar yapılabilmesini sağlamaktadır.
Drosophila melanogaster ile yapılan araştırmalar, araştırmacılarına bugüne dek 5 kere Nobel ödülü kazandırmıştır. Bunların en son örneği, biyolojik saat üzerine yapılan araştırmalara verilen 2017 yılı Nobel Fizyoloji ya da Tıp Ödülü'dür[2].
Drosophila melanogaster Türkçede "sirke sineği", İngilizcede "meyve sineği (Fruit Fly)" olarak anılan iki kanatlı bir böcek türünün Latince adıdır. Moleküler genetik, gelişimsel biyoloji ve sinirbilim çalışmalarında sık sık kullanılır. Ayrıca uzaya ilk giden hayvan türüdür.
Ruồi giấm thường hay Ruồi trái cây thường (Drosophila melanogaster) là một loài ruồi, thuộc họ Drosophilidae. Bắt đầu từ Charles W. Woodworth, loài này là một động vật mô hình được sử dụng rộng rãi trong nghiên cứu sinh học gen, sinh lý học, sinh bệnh học vi khuẩn và tiến hóa lịch sử sự sống. Nó thường được sử dụng bởi vì nó là một loài là dễ dàng để chăm sóc, sinh sản một cách nhanh chóng, và đẻ trứng nhiều.[2]
Ruồi giấm thường hay Ruồi trái cây thường (Drosophila melanogaster) là một loài ruồi, thuộc họ Drosophilidae. Bắt đầu từ Charles W. Woodworth, loài này là một động vật mô hình được sử dụng rộng rãi trong nghiên cứu sinh học gen, sinh lý học, sinh bệnh học vi khuẩn và tiến hóa lịch sử sự sống. Nó thường được sử dụng bởi vì nó là một loài là dễ dàng để chăm sóc, sinh sản một cách nhanh chóng, và đẻ trứng nhiều.
Длительность онтогенеза дрозофилы (время развития от откладки яйца до выхода имаго из куколки) при 25 °C — около 10 дней, при 18 °C — примерно в два раза больше. Самка откладывает в загнивающий фрукт или другой органический материал яйца длиной около 0,5 мм каждое[2] (за всю свою жизнь — около 400 штук). Личинки вылупляются через 24 часа. Вылупившиеся личинки растут на протяжении 5 дней, дважды линяя за это время: через 24 и 48 часов после вылупления. В течение этого времени они питаются микроорганизмами, разлагающими фрукт, а также веществами самого фрукта. Наконец, личинка окружается пупарием и превращается в куколку. Стадия куколки длится около пяти суток. Под покровами куколки происходит катастрофический метаморфоз, в результате которого развиваются органы имаго.
Первое спаривание у самки происходит не ранее чем через 12 часов после выхода из куколки. Самки сохраняют сперму от самцов, с которыми они спариваются, для позднего использования. Именно по этой причине генетики должны отобрать муху женского пола до её первого спаривания (то есть девственную самку) и убедиться, что она спаривается только с конкретным самцом, выбранным для эксперимента. Оплодотворённая самка может быть «возвращена в девственницы» путём длительной инкубации при температуре 10 °C, что убивает сперму, согласно «красной книге» Майкла Эшбёрнера (Michael Ashburner).
Геном Drosophila melanogaster содержит 4 пары хромосом: пара X/Y и три аутосомы, маркируемых как 2, 3 и 4. Четвёртая хромосома мелкая, точковидная; X (или первая), 2 и 3-я хромосомы — метацентрические. Геном состоит из примерно 132 миллионов пар оснований и содержит приблизительно 13 767 генов. В настоящее время геном секвенирован и аннотирован.
Геном: 0,18 (0,12-0,21) пг (C value)[4]
Около 61 % известных человеческих заболеваний имеют узнаваемое соответствие в генетическом коде плодовой мушки, 50 % белковых последовательностей имеют аналоги у млекопитающих. Дрозофилы используются в генетическом моделировании некоторых человеческих заболеваний, включая болезни Паркинсона, Хантингтона и Альцгеймера. Мушка также часто используется для изучения механизмов, лежащих в основе иммунитета, диабета, рака и наркотической зависимости.
Дрозофилам свойственно XY-определение пола. В отличие от человека, у дрозофил пол определяется не наличием Y-хромосомы, а отношением числа Х-хромосом к числу гаплоидных наборов аутосом. При отношении, равном 1, особь развивается в самку, а при равном 1/2 — в самца[комм. 1]. При нарушениях образуются бесплодные особи: так называемые интерсексы (если данное отношение лежит между 1/2 и 1), суперсамцы (отношение меньше 1/2) и суперсамки (отношение больше 1). Наличие Y-хромосомы никак не влияет на пол, но самцы без неё стерильны, так как в ней находятся гены, ответственные за сперматогенез.
Число X-хромосом Число гаплоидныхКлючевым геном в определении пола дрозофил является ген sex-lethal (sxl). Именно различие в альтернативном сплайсинге этого гена и порождает различия между двумя полами. В определении варианта сплайсинга гена sxl участвуют так называемые гены-нумераторы (числителя) (sis-a, sis-b (sisterless-a, sisterless-b), runt (runt)), локализованные в X-хромосоме, и гены-деноминаторы (знаменателя) (dpn (deadpan) , da (daughterless) , emc (extramacrohaeta) и др.), локализованные в аутосомах. И те, и те являются факторами транскрипции, от соотношения которых зависит альтернативный сплайсинг гена sxl. Активаторы (нумераторы) и репрессоры (деноминаторы) способны образовывать комплексы. В зависимости от отношения количества этих генов, активаторы либо преодолеют действие репрессоров, либо репрессоры подавят активность активаторов. В первом случае (при соотношении X:A=1, генотип женский) ген sxl начнет считываться с проксимального (раннего) промотора. Тогда при альтернативном сплайсинге будет образовываться активный белковый продукт sxl, который является фактором сплайсинга и, связываясь с собственной пре-иРНК, закрепляет такой вариант сплайсинга. В другом же случае, если репрессоры подавили активаторов (отношение X:A=0,5 — генотип мужской), транскрипция sxl начнется с дистального (позднего) промотора. При этом образуется неактивный белок, так как не вырезается «мужской экзон» (третий), в котором расположен стоп-кодон UGA, не дающий образоваться полноценной мРНК.
Белковый продукт sxl самки — активный фактор сплайсинга не только для собственной РНК, но и для пре-мРНК гена transformer (tra). У самцов sxl неактивен как фактор сплайсинга, поэтому продукт гена transformer — тоже неактивный белок.
Следующий этап в каскаде — ген Doublesex (dsx). У самок белок tra (совместно с работающим у обоих полов tra-2) модифицирует его сплайсинг, что приводит к образованию белка DsxFem (женский вариант). У самцов такой модификации не происходит, сплайсинг проходит по-другому, и образуется другой белок — DsxM (мужской вариант). Эти белки являются факторами транскрипции, влияющие на активность генов, отвечающих за развитие фенотипического пола.
У самцов концентрация белков, закодированных в X-хромосоме, примерно такая же, как и у самок, хотя самих X-хромосом у них вдвое меньше. Значит, у дрозофил существуют механизмы, создающие дозовую компенсацию, причем отличающуюся от человеческой — у женщин одна из X-хромосом отключается, в то время, как у самцов дрозофил интенсивность транскрипции с единственной X-хромосомы повышается в 2 раза. Это видно на цитологических препаратах, где хорошо заметно, что X-хромосома самца примерно на 25 % более рыхлая, чем X-хромосомы самок, в ней в 1,5 раза больше негистоновых белков. Этот эффект вызван активностью определенных белков: msl-1, msl-2, msl-3, mle и гистона H4 с ацетилированным лизином в 16-м положении. Ключевую роль во включении этого механизма играет взаимодействие генов msl-2 и пресловутого sxl. Если белок sxl нормальный (как у самок), он связывает мРНК msl-2 в так называемых UTR-участках, тем самым подавляя её трансляцию. То есть, у самок нет белка msl-2, а у самцов — есть. А при наличии белка msl-2 с ДНК могут связаться и остальные упоминавшиеся белки (msl-1, msl-3, mle и H4Ac16), которые и делают ДНК более рыхлой, что упрощает транскрипцию с X-хромосомы.
В 1971 году Рон Конопка (Ron Konopka) и Сеймур Бенцер (Seymour Benzer) опубликовали работу, озаглавленную «Clock mutants of Drosophila melanogaster»[6], в которой они описали первые мутации, которые влияли на поведение животного. В природных условиях мушки демонстрируют ритм активности с периодом примерно 24 часа. Учёные нашли мутантов с более быстрым и более медленным ритмом жизни — мушек, которые двигались и отдыхали в произвольные интервалы времени. Исследования на протяжении 30 лет показали, что эти мутации (и другие похожие) затрагивают группу генов и их производные, отвечающие за биохимические или молекулярные часы. Эти «часы» обнаружены во многих мушиных клетках, но те часовые клетки, которые контролируют активность — это несколько десятков нейронов в центральном мозгу мухи.
Крылья мушки способны колебаться с частотой до 250 раз в секунду. Полёт состоит из прямых поступательных перемещений, чередующихся со стремительными поворотами, называющимися саккадами (saccades). При таких поворотах мушка способна развернуться на 90 градусов менее чем за 50 миллисекунд.
Дрозофилы и, вероятно, многие другие мухи имеют оптические нервы, ведущие напрямую к мускулам крыльев (тогда как у других насекомых они в первую очередь всегда ведут к мозгу), что резко ускоряет их реакцию.
Долгое время думали, что характеристики[уточнить] полёта дрозофил определяются вязкостью воздуха, а не инертностью их тела. Последние исследования Майкла Дикинсона (Michael Dickinson) и Розалин Сэяман (Rosalyn Sayaman) показали, что когда мушка выполняет поворот, она сначала ускоряется, потом замедляется на повороте и затем снова ускоряется в конце поворота. Это показывает, что инертность здесь преобладающая сила, как и в случае с большими летающими животными.
Плодовые мушки благодаря темпам своего размножения давно стали популярным кормовым объектом в террариумистике. Массовое разведение дрозофилы в качестве корма[7] особенно важно для любителей мелких амфибий и рептилий, в особенности представителей семейства древолазов (Dendrobatidae). Чаще всего выращиваются различные бескрылые формы мушек, которых значительно легче поймать террариумным животным. Любителями разработано множество рецептов питательных сред для массового культивирования дрозофил. Иногда Drosophila melanogaster выращивается в качестве дополнительного живого корма для аквариумных рыб.
Насекомое относится к подроду Sophophora (англ.)русск. рода Drosophila. Этот род оказался парафилетическим, что создало возможность его раздела и выделения Sophophora в самостоятельный род. В таком случае название вида изменилось бы, что привело бы к неудобствам вследствие огромного количества посвящённых ему работ. Было высказано предложение[8] в порядке исключения из правил сделать D. melanogaster типовым видом рода[комм. 2], чтобы она сохранила название при его возможном разделе. Однако Международная комиссия по зоологической номенклатуре в 2010 году отклонила[9] это предложение[10][11][12].
Длительность онтогенеза дрозофилы (время развития от откладки яйца до выхода имаго из куколки) при 25 °C — около 10 дней, при 18 °C — примерно в два раза больше. Самка откладывает в загнивающий фрукт или другой органический материал яйца длиной около 0,5 мм каждое (за всю свою жизнь — около 400 штук). Личинки вылупляются через 24 часа. Вылупившиеся личинки растут на протяжении 5 дней, дважды линяя за это время: через 24 и 48 часов после вылупления. В течение этого времени они питаются микроорганизмами, разлагающими фрукт, а также веществами самого фрукта. Наконец, личинка окружается пупарием и превращается в куколку. Стадия куколки длится около пяти суток. Под покровами куколки происходит катастрофический метаморфоз, в результате которого развиваются органы имаго.
Первое спаривание у самки происходит не ранее чем через 12 часов после выхода из куколки. Самки сохраняют сперму от самцов, с которыми они спариваются, для позднего использования. Именно по этой причине генетики должны отобрать муху женского пола до её первого спаривания (то есть девственную самку) и убедиться, что она спаривается только с конкретным самцом, выбранным для эксперимента. Оплодотворённая самка может быть «возвращена в девственницы» путём длительной инкубации при температуре 10 °C, что убивает сперму, согласно «красной книге» Майкла Эшбёрнера (Michael Ashburner).
黑腹果蝇也称黑尾果蝇(学名:Drosophila melanogaster),是被人类研究得最彻底的生物之一,为模式生物。从查尔斯·伍德沃斯(英语:Charles W. Woodworth)(Charles W. Woodworth)关于利用该物种作为模式生物的建议开始,黑腹果蝇继续被广泛用于遗传学,生理学,微生物发病机理和生命历史进化(英语:Life history theory)的生物学研究。 截至2017年,已有8个诺贝尔奖颁发给使用果蝇的研究[2]。
黑腹果蝇通常被用于研究,因为它可以很容易地在实验室饲养,只有四对染色体,迅速繁殖,并且产很多卵[3]。 其地理范围包括各大洲,包括岛屿[4]。黑腹果蝇是家庭,餐馆和其他有食物的地方常见的害虫[5]。
黑腹果蝇是一种原产于热带或亚热带的蝇种。它和人类一样分布于全世界,并且在人类的居室内过冬。雌性体长2.5毫米, 雄性较之还要小。雄性有深色后肢,可以此来与雌性作区别。
雌蝇可以一次产下5个0.5毫米大小的卵,总共约400个。它们有绒毛膜和一层卵黄膜包被,其发育速度受环境温度影响。在25℃环境下,22小时后幼虫就会破壳而出, 并且立刻觅食。因为母体会将它们放在腐烂的水果上或其他发酵的有机物上,所以它们的首要食物来源是使水果腐烂的微生物,如酵母和细菌,其次是含糖的水果。幼虫24小时后就会第一次蜕皮,并且不断生长,以到达第二幼体发育期。经过三个幼虫发育阶段和四天的蛹期,在25℃下过一天,就会发育为成虫。
黑腹果蝇在1830年首次被描述。而它第一次被用作试验研究对象则要到 1901年,试验者是动物学家和遗传学家威廉·恩斯特·卡斯特。他通过对果蝇的种系研究,设法了解多代近亲繁殖的结果和取自其中某一代进行杂交所出现的现象。
1910年,汤玛斯·亨特·摩尔根开始在实验室内培育果蝇并对它进行系统的研究。之后,很多遗传学家就开始用果蝇作研究,并且取得了很多遗传学方面的知识,包括这种蝇类基因组裡的基因在染色体上的分布。
黑腹果蝇在20世纪前半叶成为动物学家和遗传学家汤玛斯·亨特·摩尔根及其学派实验研究对象。它只有四对染色体。一对性染色体,通常被记作第一对染色体或者是X-和Y-染色体,和三对常染色体,后者被记作第二,三和四对染色体。第四对染色体很小,所含的基因也很少。果蝇非常合适用于研究,在一个瓶子裡就可以培育大量的果蝇,繁殖速度快。“用半瓶牛奶和一條开始腐烂的香蕉就够了,14天就可以得到200只果蝇”马田·布克斯在他2002年出版的书Drosophila裡写道。科学家用果蝇进行了无数次杂交, 其中包括确定了基因裡面的基因连锁群,它们位于同一染色体上面,科学家也因此发现了联会现象,并且对某些变异进行了描述和研究,例如眼睛颜色由红变异为白色或者是微型翅膀——这种果蝇丧失了飞行能力。赫爾曼·約瑟夫·馬勒是第一位发现伦琴射线对遗传物质具有的诱变作用。从此射线就被大量使用,以诱发果蝇发生变异。
在2000年对其13.600 基因测序完成。部分基因与人类的基因有惊人的相似。研究发现,在果蝇的遗传物质裡找到了人类的致癌基因或者潜在的,在变异情况下参与癌症发生的癌基因(Oncogene)。
在发育生物学研究方面人类也从果蝇身上获得了很多知识。早在1900年哈佛大学的教授威廉·卡斯特就首次将果蝇用作胚胎研究的对象。从此果蝇就在这一领域被广泛采用。20世纪70年代克里斯汀·紐斯林-沃爾哈德(Christiane Nüsslein-Volhard)开始研究果蝇的发育基因。她从中得知,卵细胞中的四个基因决定了或是监控了受精卵的发育(参见Hox基因)。1980年她发表了论文“影响黑腹果蝇体节数目和极性的变异”,她也因此获得了1995年的诺贝尔医学奖。
黑腹果蝇易于培养和繁殖,经济。在基因研究方面,果蝇是最常见的研究对象,原因是它14天就可以繁殖一代,只有四对染色体,还有它可以显示很多变异。
经过卵细胞受精,精卵细胞核融合后,细胞核很快的连续同步分裂(有丝分裂),但是这些细胞核处在同一细胞膜裡。可以说这是个多核细胞胚胎。人们称之为“合胞体胚盘”。第七次核裂后,这些细胞核会游离到细胞膜下。在第九第十次核裂的时候八到十个核开始自行分裂。这些细胞成为生殖细胞,被称为极细胞。 产卵后两个半小时,合胞体胚盘的细胞膜向内折叠包绕各个细胞核,成为“细胞胚盘”。至此,果蝇胚胎细胞的第一层单层表皮形成。细胞核也开始转向非对称分化。其分化方向与该细胞在胚胎中所处的位置有关。
腹侧延长轴的卵裂标志着原肠胚开始形成,在原肠胚种会形成三个胚层:腹侧的卵裂形成中胚层。腹沟的前段内陷,形成口道,腹沟的后侧内陷则形成肛窝,与后来形成的内胚层分开。胚胎外层的细胞和口道,肛窝末端的细胞内陷形成外胚层。随着胚带的延长,后段的极细胞开始向胚胎内分裂。器官分化开始,分节现象已经可以看到。在受精大约7.5小时后胚带开始缩短,结束于背向闭合。受精后22小时,经过一系列的分化发展,幼虫就会发育形成。
幼虫能在几天内通过进食从卵体大小(0.5毫米)长到正常形态大小(2.5毫米)。其间蜕皮两次,所以可以将它的幼体发育分成三个阶段。
晚期三龄幼虫从食物中爬出,寻找合适的位置并化蛹。幼虫身体缩短,角质层与表皮逐渐分离成为蛹壳,经过五天的变态发育,最后破蛹而出,成为成虫。
蛹壳半透明,呈黄褐色,或深黄褐色,长椭圆形。蛹的前端有一呼吸管伸出。.....
在美国每年会在不同城市举行一次最大型的国际果蝇会议,有大概2000人参与。欧洲的果蝇会议则每两年一次,在不同的欧洲国家举行,有大概400到500人参与。德国则每年有小型的地方聚会。讨论的主题有果蝇在生命科学,发育生物学与神经科学方面的应用。
在实验室裡,科学家让果蝇产生了无数种变异。通过系统筛选,科学家通常选择其基因组裡面大概13400基因进行诱导,使果蝇变异。过程通常是用有明显表现型的纯合子杂交,以得到下一代F1和F2,就可对其进行研究了。常见的变异有:
黑腹果蝇也称黑尾果蝇(学名:Drosophila melanogaster),是被人类研究得最彻底的生物之一,为模式生物。从查尔斯·伍德沃斯(英语:Charles W. Woodworth)(Charles W. Woodworth)关于利用该物种作为模式生物的建议开始,黑腹果蝇继续被广泛用于遗传学,生理学,微生物发病机理和生命历史进化(英语:Life history theory)的生物学研究。 截至2017年,已有8个诺贝尔奖颁发给使用果蝇的研究。
黑腹果蝇通常被用于研究,因为它可以很容易地在实验室饲养,只有四对染色体,迅速繁殖,并且产很多卵。 其地理范围包括各大洲,包括岛屿。黑腹果蝇是家庭,餐馆和其他有食物的地方常见的害虫。

キイロショウジョウバエ(黄色猩々蝿)は、ハエ目(双翅目)・ショウジョウバエ科の昆虫である。生物学のさまざまな分野でモデル生物として用いられ、多くの発見がなされた。特に遺伝学的解析に優れた性質をもつ。単にショウジョウバエといえば本種を指すことも多い。
キイロショウジョウバエは体長3mm前後と小さく、自然界では熟した果物類や樹液およびそこに生育する天然の酵母を食料とする。酵母は果実や樹液を代謝しアルコール発酵を行うため、ショウジョウバエは酒や酢に誘引されると考えられる。糞便や腐敗動物質といったタイプの汚物には接触しないため、病原菌の媒体になることはない。この種はアフリカ中央部に起源を持ち、現在では世界各地の暖かい地域で見られる。寒い地域でも夏場だけ移動してきたり、暖かい場所で冬を越したりする。冬眠することはない。
日本では野外や人家(主に台所など食品がある場所)で普通に見られる。俗に「コバエ」とも呼ばれ、身近に見られることや、後述の生物学的な特性から小学校でのバナナなどの果物を使って捕獲する実験に始まり、大学の生物学や遺伝学での実験まで広く利用されている。 一方、大量に発生すると不快感を感じさせるため、誘引して殺すための殺虫剤が入ったトラップ器具が大手殺虫剤メーカから発売されている。
キイロショウジョウバエのモデル生物としての利点は以下のことが挙げられる。
ショウジョウバエの世代間隔は10日(25℃)。寿命は2か月。一匹のメスは、1日に50個前後の卵を産むことができる。体長2〜3 mm。研究室では、成虫・幼虫ともに乾燥酵母、コーンミール、蔗糖などを寒天で固めたエサで飼育される(写真)。
ショウジョウバエは胚期、幼虫期、蛹期、成虫期の4つの発生段階をもつ完全変態昆虫である。幼虫期には2回脱皮を行い、それぞれ一齢幼虫、二齢幼虫、三齢幼虫と呼ばれる。25℃で飼育すると、胚期: 一日、一齢幼虫期: 一日、二齢幼虫期: 一日、三齢幼虫期: 二日、蛹期: 五日を経て成虫になる。
卵には細胞核や栄養だけでなく、様々な遺伝子産物が母親から供給されている。これらの遺伝子産物には卵の中で片寄って存在しているものがあり、この偏りが胚内での位置情報となり、体軸や生殖細胞の形成などに重要な役割をもつ。受精核は分裂して細胞表層に移行し、表割を行う。極初期に決定された位置情報を元にシグナル伝達などを介した形態形成が速やかに進行する。幼虫期の脱皮・変態は幼若ホルモンやエクジソンによって制御されている。幼虫の体内には将来成虫の体を形成する成虫原基という組織がある。成虫原基は三齢幼虫後期に増殖・分化し始め、蛹の間に成虫の体を形作る。
四対の染色体があり、性染色体を第一染色体として、常染色体を第二、第三、第四染色体と呼ぶ。性染色体はヒトと同じ XY 型だが性決定機構は異なる。第四染色体は非常に短いため、しばしば無視される。幼虫の唾液腺の染色体は核分裂を伴わずにDNA複製を繰り返し、多糸化するため非常に巨大になる。この唾液腺染色体に見られるバンドパターンは詳細に記載され、組み換え価との比較から細胞学的遺伝子地図が作成された。ゲノムサイズは1.65x108塩基対、おおよそ14,000の遺伝子があると推測されている。2000年には(ほぼ)すべてのゲノム塩基配列が解読された。多細胞生物としては線虫に次いで二番目(ゲノムプロジェクト)。
ヒトの病気の原因として知られている遺伝子の61%がショウジョウバエにもあり、遺伝的にはヒトとショウジョウバエは非常に似ているということができる。パーキンソン病やハンチントン病などのヒト疾患の病理メカニズムを解明するためのモデルとしても注目されている。
成虫は正の走光性と負の走地性をもつ。さらに分子解剖学的に脳の神経回路を全て記述する試みがなされている。交尾はショウジョウバエで最も詳しく観察された行動であり、性決定などに関する研究がある。夜(暗期)には哺乳類の睡眠に類似した行動を示す。これはサーカディアンリズム(概日周期)を刻み、この周期が変化する変異体も得られている。さらに、1970年代後半から始まった研究により、ショウジョウバエは記憶や学習といった行動を示すことが明らかとなった。その後の、遺伝学的な解析から様々な記憶・学習に関係する遺伝子が同定され、近年では蛍光タンパクなどを用いた記憶や学習を司る脳の回路解析が行われている。また、アルツハイマー病やパーキンソン病などのモデル動物も作成され、脳機能解析における実験動物として有用視されている。
ショウジョウバエ研究は一世紀にわたる歴史を持つ。初期は遺伝学の材料として、現在では主に発生生物学のモデル生物として用いられている。遺伝子に関連した部分での動物の発生における多くの知見は、ショウジョウバエ研究で最初に明らかにされてきた。
ショウジョウバエが生物学の材料として登場するのは、1901年、当時ハーバード大学にいたC.W.ウッドワース(英語版)が大量飼育し、W.E. キャッスル(英語版)に遺伝学の材料として薦めたのが最初と言われる。遺伝学の研究材料として有名にしたのはT.H. モーガンとその一派(C.B. ブリッジス、A.H. スターティヴァント(英語版)、H.J. マラーら)。彼等は1908年からショウジョウバエを用いはじめ、1910年には最初の突然変異体、white(白眼)を発見した。さらに、変異体と異常染色体の関連を観察し、遺伝子が染色体上に存在することを証明(三点交雑法により、染色体上の遺伝子の配列を表した連鎖地図を作成)し、染色体説を実証した。この業績によりモーガンは1933年にノーベル生理学・医学賞を受賞。
遺伝学研究では突然変異体を用いるのが常法だが、自然状態で突然変異が起こる確率は非常に低く、発見が困難だった。この問題はH.J.マラーの研究によって解消される。マラーは、ショウジョウバエにX線を照射すると、表現型に遺伝的な影響を及ぼすことを発見し、これがX線による遺伝子突然変異(人為突然変異)であることを明らかにした(1927年)。この業績により彼は1946年にノーベル生理学・医学賞を受賞している。以降、多数の突然変異体系統や異常染色体系統が樹立された。
このようにして古典遺伝学は隆盛を見る。しかしここまでの遺伝学では表現型の観察は主に成虫を用いており、発生に関する知見は乏しかった。
動物発生学では主に胚を研究材料としていた。観察や実験操作の容易さから大きな卵を持つカエルやウニが用いられることが多く、ショウジョウバエの胚は小さく、不透明な卵殻を持っているため発生学には向かないとされていた。また昆虫の発生はヒトとは全く異なるため、研究する意義が低いと考えられていた。しかし顕微鏡や観察技術、分子生物学の発展にともないホメオボックスが発見されるに至ると、ショウジョウバエで培われた遺伝学は発生学と融合することになる。
ホメオボックスはホメオティック変異の研究から発見された。ホメオティック変異 (homeotic mutation) とはある組織や器官が別の組織や器官になるという変異である。ショウジョウバエで初めてのホメオティック変異 bx (bithorax) はモーガン研究室のブリッジスによって1915年に発見されていた。bx 変異体の組み合わせによっては胸部第三節が第二節に変化し、四対の翅をもつようになる。モーガンの孫弟子にあたる E.B. ルイスは多数の bx 変異を作成し、この変異表現型が BX 遺伝子群によって引き起こされるという説を発表した(1978年)。
この間に遺伝子発現の定義が分子生物学によってなされ、ショウジョウバエでも遺伝子クローニングや遺伝子導入といった分子生物学的手法が導入された。また小さな胚を扱うための顕微鏡や観察技術も発展した。さらに幸運なことに1976年にはP因子と呼ばれるトランスポゾンが発見され、1982年頃からはそれまで細菌や酵母でしか行えなかった遺伝子導入が比較的容易に行えるようになった。以降P因子を用いた様々な技術が開発されている。
分子生物学的手法を用いて、1983年から84年にかけて、W.J. ゲーリングらと T. カウフマンらによってホメオティック変異の原因遺伝子が独立にクローニングされた。塩基配列を決定したところホメオティック遺伝子には 180 bp (60 aa) の共通した配列があり、ホメオボックスと名付けられた。驚くことに、ホメオボックスを持つ遺伝子はショウジョウバエだけでなく、ヒトから線虫、植物、酵母など真核生物に広く存在していることが明らかになった。生物は発生のような複雑な現象においても、基本的には共通の系を使っていたのである。このことは線虫を始め、他のモデル生物研究を加速させた。
1980年代、C. ニュスライン-フォルハルトとE.F. ウィーシャウスは大量の突然変異系統を樹立し、ショウジョウバエ胚の体節形成に注目した表現型の観察を行った。彼等は胚におけるタンパク質の濃度勾配が体節形成に重要であることを明らかにし、この研究でホメオティック遺伝子の発現機構が解明された。
このように発生を遺伝子の言葉で説明することができるようになり、発生学と遺伝学は統合された。このことは1995年に「初期胚発生の遺伝的制御に関する発見」により E.B. ルイス、ニュスライン-フォルハルト、ウィーシャウスらがノーベル生理学・医学賞を受賞していることに象徴される。発生学の分野では1935年のハンス・シュペーマンの受賞から60年後のことである。
ゲノムプロジェクトによるゲノム解読終了は、分子生物学的研究をさらに発展させることになる。また比較ゲノム学的な観点から、進化の研究も行いやすくなった。キイロショウジョウバエのいくつかの近縁種でもゲノムプロジェクトが進行中である。
1920年にアメリカのパールは人口統計学の基礎研究としてショウジョウバエの個体群成長について実験を行い、ロジスティック曲線を提唱した。また、これにかかわって密度効果を見いだした。ただし、それ以降の研究では使われることが少なくなった。これは、寒天培地などの餌がこの分野でのより詳細な分析には向かなかった(たとえば培養中に虫のみを選りだして別の培地に移すなどの操作が困難)ためで、コクヌストモドキ等がそれ以降は使われた。
遺伝子の命名法は生物種によって多少異なる。ここではショウジョウバエについて紹介する。
突然変異の解析から同定された遺伝子は、最初に得られた変異体の表現型にちなんだ命名をされる。この場合、遺伝子はその機能と逆の名前がつけられる。遺伝子名は斜体で表記し、劣性変異は小文字で、優性変異は大文字で始める。近年は、ほ乳類などで解析が進んでいたものをショウジョウバエでも逆遺伝学的に研究する例も増え、その場合はしばしば D. melanogaster の省略である d や D、Dm を遺伝子名の前につけることが、かつてあった。論文等における発表では、このような表記が使われることはあるが、事実上の標準であるFlyBaseに登録されるとき、こうした接頭語は冗長であるとの理由により修正される。通常、遺伝子名は遺伝子記号と呼ばれる略称で表記される。初期に発見された遺伝子は一文字や二文字(例えば white は w)だったが、近年では三文字以上を用いる。
例)遺伝子名(遺伝子記号)- 備考
ショウジョウバエ研究者はウィットを利かせた(ときとしてダジャレのような)遺伝子名を付ける伝統を持つ。例えば musashi(毛が二本になる→二刀流の宮本武蔵)、 satori(オスが交尾をしない→悟りの境地)、 hamlet(神経になるべきかならざるべきか→シェークスピアの戯曲「ハムレット」)、bose(毛が見られない→坊主)など。他生物種の研究者の中にはこのような習慣に否定的な意見をもつ人もおり、Nature 誌で議論がなされたことがあったが、ショウジョウバエ研究者は概ねこの伝統を誇りにしているようである。
キイロショウジョウバエ(黄色猩々蝿)は、ハエ目(双翅目)・ショウジョウバエ科の昆虫である。生物学のさまざまな分野でモデル生物として用いられ、多くの発見がなされた。特に遺伝学的解析に優れた性質をもつ。単にショウジョウバエといえば本種を指すことも多い。
노랑초파리는 초파리과에 속하는 곤충으로, 몸길이는 2~2.5mm이고, 몸빛깔은 황적색이다. 머리는 가슴 폭과 같거나 조금 넓으며, 겹눈은 어두운 적갈색이다. 더듬이는 황갈색을 띤다.
가을에 흔히 볼 수 있다. 유충은 썩은 과일, 된장 등에서 발생한다. 유충은 두 번 탈피한 뒤 번데기가 되는데, 이 때 유충의 껍질이 그대로 줄어들어 번데기 껍질이 된다. 우화한 성충은 약 10시간 안에 짝짓기를 하고, 1~2일 뒤에 알을 낳는다. 한 세대는 섭씨 25도에서 10일, 15도에서 20일을 산다. 암수 구분은 수컷은 몸 크기가 작고 배 끝이 검다는 점을 이용하면 좋다.
유전학 실험에서 널리 사용하는 모델 생물이다. 배양은 주로 초파리관병과 콘밀 배지를 이용한다.
노랑초파리의 발달기간은 온도에 따라서 달라진다. 가장 짧은 것은 온도가 28 °C (82 °F)일때이며 알에서 성체까지 7일만에 자란다.[1][2] 온도가 더욱 올라가면 성장기간이 길어지는데 (30 °C (86 °F)에서 11일), 이것은 열로 인한 스트레스 때문이다. 이상적인 조건에서, 온도가 25 °C (77 °F)일 때 성장기간은 8.5일이고,[1][2][3] 18 °C (64 °F)에서는 19일[1][2] 12 °C (54 °F)에는 50일이 걸린다.[1][2] 많은 수가 밀집해있는 상태에서는 성장기간이 길어지고[4] 성체의 크기도 작아진다.[4][5] 암컷은 한번에 5개씩에서 약 400개의 알을 썩는 과일이나 버섯등 다른 적당한 장소에다 낳는다. 알의 길이는 약 0.5 mm 이고 25 °C (77 °F)에서 12-15시간내에 부화한다.[1][2] 알에서 나온 유충은 4일간 자라며 (25 °C에서) 부화한지 24-48시간 내에 허물벗기를 두번한다.[1][2] 이 동안, 썩는 과일안의 미생물들을 먹기도 하며 과일의 당분을 섭취한다. 그 다음 유충은 고치를 만들고 25 °C에서 4일정도의 탈피과정을 거친 다음 성충이 나온다.[1][2]
다